请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
(1)已知:
①Fe(s)+ O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
②2Al(s)+ O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是____________________________________
(2)某可逆反应在不同条件下的反应历程分别为A、B(如上图所示)。
①根据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为________(选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)1000 ℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
该反应的平衡常数表达式为________________________________;
已知K1000 ℃<K1200 ℃,若降低体系温度,混合气体的平均相对分子质量将会________(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)________。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
近年来我国汽车拥有量呈较快增长趋势,NOx是汽车尾气中的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式:_________________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是___________________________
(2)在汽车上安装高效催化转化器,可有效降低NOx的排放。某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下反应2NO+2CO N2+2CO2 ΔH<0的反应速率。
N2+2CO2 ΔH<0的反应速率。
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)(×10-4 mol·L-1) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)(×10-3 mol·L-1) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2 s内的平均反应速率v(N2)=________。
②在该温度下,反应的平衡常数K=________L·mol-1(写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明________(填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)通过NOx传感器监测NOx的含量,其工作原理示意图如上图:
①Pt电极上发生的是__________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:________________________________________。
新的《环境空气质量标准》将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因________________________________________
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________kJ·mol-1;该反应的ΔS________0(填“>”“<”或“=”)。
(3)将0.20 mol NO和0.10 mol CO充入一个容积恒定为1 L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。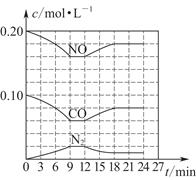
①计算产物N2在6~9 min时的平均反应速率v(N2)=________mol·L-1·min-1;
②第12 min时改变的反应条件为________(填“升温”或“降温”);
③计算反应在第24 min时的平衡常数K=________。若保持温度不变,再向容器中充入CO、N2各0.060 mol,平衡将________移动(填“正向”“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20 ℃的数据如下表:
| 溶解度(S)/g |
溶度积(Ksp) |
||
| Ca(OH)2 |
Ba(OH)2 |
CaSO3 |
BaSO3 |
| 0.160 |
3.89 |
6.76×10-3 |
5.48×10-9 |
①吸收SO2最合适的试剂是________[填“Ca(OH)2”或“Ba(OH)2”]溶液;
②在20 ℃时,向CaSO3悬浊液中滴加适量的BaCl2溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的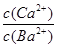 =____________(写出表达式即可)。
=____________(写出表达式即可)。
A、B、C、D、E、F元素是原子序数依次增大的6种短周期元素。已知A是短周期元素中原子半径最小的元素,A和B形成的18电子的化合物X常用作火箭的燃料,C原子最外层电子数与核外电子总数之比为3∶4,E与C同主族,D和C可以形成原子个数比为1∶1和2∶1的两种离子化合物。
据此回答下列问题:
(1)D和C形成1∶1的化合物中阴阳离个数比为____________。
(2)化合物X的结构式为____________。1 mol气态X在适量C2中燃烧,生成B2和气态A2C, 放出534 kJ的热量,1 mol液态A2C完全汽化需吸收44 kJ热量。请写出气态X在C2中燃烧生成B2和液态A2C时的热化学方程式_____________________________________
(3)某化合物由上述6种元素中的3种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为__________________;该化合物水溶液不呈中性的原因是(用离子方程式表示)__________________________________,该化合物可以通过电解D和F形成化合物的水溶液获得,电解时反应的化学方程式为_________________________________
(4)写出一个可以证明C的非金属性大于E的化学反应方程式:_____________________________________________。
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径(nm) |
0.102 |
0.110 |
0.117 |
0.074 |
0.075 |
0.071 |
0.099 |
0.077 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是________________;
(2)C和H的气态氢化物的稳定性强弱关系为______________(用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_____________________________________。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3===2________+CO2
横线上某盐的化学式应为________。
(5)在一密闭容器中发生反应2AD2+D2 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。在下列方框内绘出该实验方案装置图。