已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)16CO3·4H2O,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应。某研究性学习小组设计了如下实验探究铝碳酸镁片的组成。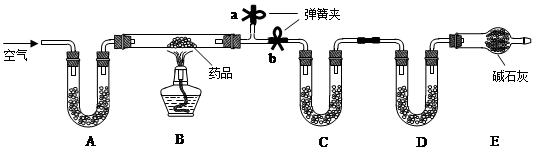
【实验一】取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g。
(1)铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2和水,则为分别测定CO2和水的质量,装置C和D中盛放的药品应选择:C D (填序号)。
①浓硫酸 ②碱石灰 ③氯化钙 ④纯碱
(2)实验开始前先通入一定量空气,其操作方法是关闭弹簧夹 ,打开弹簧夹 ,目的是 。
(3)一段时间后,打开弹簧夹 ,关闭弹簧夹 ,点燃酒精灯加热,充分反应后,停止加热,继续通入空气至玻璃管冷却的目的是 (填序号)。
①排净空气防爆炸
②防止空气中水和二氧化碳进入C、D影响测定
③使生成水和二氧化碳进入C、D被充分吸收
【实验二】另取m g该药片,加入100 g 9.8%的稀硫酸,充分反应后滤去不溶物,得到含有MgSO4和Al2(SO4)3等溶质的滤液,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。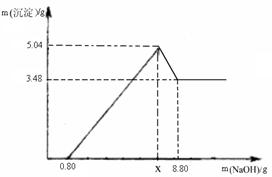
已知:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al(OH)3+NaOH=NaAlO2+2H2O,
Mg(OH)2不溶于NaOH, NaAlO2可溶于水。
(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 。当加入NaOH的质量到x时,生成的沉淀有 和 ,其中Al(OH)3的质量是 g,则x= g。
(2)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是 。
(3)试确定铝碳酸镁的化学式为 。
将20g硫酸钠和氯化钠的混合物,加入到103.3g的氯化钡溶液中,完全反应后,过滤,所得到滤液的质量为100克.试计算:
(1)反应后生成白色沉淀质量为 g.
(2)原混合物中氯化钠的质量分数为多少?(写出计算过程)
化学实验室常取用氢氧化钠溶液,当多次揭开其瓶盖后,同学们猜想该试剂可能变质了,在征得老师同意后,开展了以下探究:
【提出问题1】该瓶氢氧化钠溶液是否变质了呢?
【实验探究1】
|
实验操作 |
实验现象 |
化学方程式 |
实验结论 |
|
取少量该溶液于试管中,滴加几滴稀盐酸 |
有气泡产生 |
|
氢氧化钠溶液一定变质了 |
NaOH溶液变质的原因 (用化学方程式表示)
【提出问题2】该瓶氢氧化钠溶液是全部变质还是部分变质呢?
【查阅资料】氯化钙溶液、氯化钠溶液均呈中性,碳酸钠溶液呈碱性.
【实验探究2】
|
实验操作 |
实验现象 |
实验结论 |
|
①取少量该溶液于试管中加水溶解,滴加过量的CaCl2溶液,并不断振荡 |
|
说明原溶液中一定含有Na2CO3 |
|
② ,滴加酚酞溶液 |
溶液变为红色 |
说明原溶液中一定还含有NaOH |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)在上述【实验探究2】中,甲提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”),原因是 (用化学方程式表示).
(2)若将【实验探究2】中加入的酚酞溶液换为某盐溶液,会产生与中不同的实验现象,也可得出中相同的结论.写出一种符合条件的盐的化学式 .
【理解与应用】氢氧化钠溶液容易变质,必须密封保存,用后应立即盖上瓶盖.
学习化学知识和技能,可以帮助我们鉴别和检验物质。
(1)在实验室鉴别白酒与白醋,可采用的方法是 。
(2)现有两瓶失去标签的无色溶液,其中一瓶是氢氧化钙溶液,一瓶是稀盐酸。为了鉴别它们,同学们设计了如下实验方案:先给两瓶溶液贴上标签A、B,然后分别取样进行实验。请将横线部分填写完整:
|
加入的试剂 |
现象 |
结论 |
|
|
方案1 |
二氧化碳 |
A中出现白色浑浊,B中无明显现象。 |
A是 溶液, B是另一种溶液。 |
|
方案2 |
碳酸钠溶液 |
。 |
|
|
方案3 |
试剂X |
…… |
写出方案1中发生反应的化学方程式 。
【方法感悟】在鉴别物质时,要先分析物质的性质,然后选择恰当的试剂,必须产生不同现象才能达到鉴别物质的目的。
【拓展应用】完成方案3,请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X: 。(填序号)
①酚酞溶液 ②pH试纸 ③镁 ④氧化铜
⑤稀硝酸 ⑥氢氧化铜 ⑦氯化镁溶液 ⑧硝酸钡溶液
(3)小华同学对方案2进一步探究,设计了如下实验方案:

溶液C和溶液D混合,可能会出现以下三种情况:
①有沉淀产生时,写出其中发生反应的化学方程式 。
②有气泡冒出时,可通过现象反推出溶液C中的溶质是 。
③无明显现象时,混合物E中一定含有的溶质是 ;混合物E中所含溶质种类最多时,写出所有溶质的化学式 。
咸宁市市某校2018年实验操作模拟考试的一个考题是:用碳酸钠溶液鉴别稀盐酸、食盐水和澄清石灰水。
【进行实验】
|
实验步骤 |
实验现象 |
实验结论 |
|
分别用a,b,c三支试管取样,各加入一定量碳酸钠溶液 |
a中有气泡产生 |
a中物质是稀盐酸 |
|
b中无明显现象 |
b中物质是食盐水 |
|
|
c中 |
c中物质是澄清石灰水 |
写出a试管中发生反应的化学方程式 。
把c试管反应后的物质进行过滤,得到滤液。
【提出问题】滤液中溶质的成分是什么?
猜想一:Na 2CO 3和NaOH;猜想二:NaOH;猜想三: 。
提示:Ca(OH) 2微溶于水。
【实验过程】为证明猜想一是否正确,进行了如下实验
|
实验步骤 |
实验现象 |
实验结论 |
|
取一定量滤液于试管中,加入一种盐溶液(写物质化学式) |
有白色沉淀 |
猜想一正确 |
写出上述有白色沉淀生成的化学方程式 。
同学们还对a试管反应后废液的酸碱性感兴趣,决定用pH试纸测定其pH值。
|
用pH试纸测定a试管反应后废液碱性的过程 |
测定结果 |
|
在白瓷板上放一小片pH试纸,用玻璃棒蘸取 。 |
pH<7(废液显酸性) |
【反思与交流】a试管中的废液显酸性,从环保、经济、操作简便等方面考虑,应向废液加入(写化学式) 后再排放。
有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如图所示实验:

(1)向样品中加入过量稀盐酸产生的气体是 。
(2)向固体A中加入硝酸银溶液,发生反应的化学方程式为 。
(3)固体B中含有的物质是 。
(4)原固体样品中一定含有的物质是 。
(5)蓝色溶液丙中一定含有的溶质是 。