将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
| A.①>②>③>④ | B.①>②>④>③ |
| C.①=②>③>④ | D.①=②>③=④ |
含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见右表)
| 离子 |
Mg2+ |
Al 3+ |
物质 |
Al(OH)3 |
| 开始沉淀pH |
8.93 |
3.56 |
开始溶解pH |
8.04 |
| 完全沉淀pH |
10.92 |
4.89 |
完全溶解pH |
12.04 |
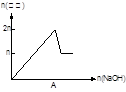
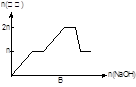


常温下,0.1 mol/L氨水溶液中 =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是
| A.该溶液中氢离子的浓度:c(H+ ) = 1×10-9 mol/L |
| B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中: c(NH4+ ) + c(H+ ) = c(Cl- ) + c(OH-) |
| C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中: c(NH4+ ) + c(NH3) + c(NH3·H2O) = 2c(SO42-) |
| D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |
c(NH4+ )> c (NH3·H2O) > c(Cl-) > c(OH-) > c(H+ )
已知NO2遇水发生反应:2NO2 + H2O → HNO2 + HNO3。实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2。下列说法错误的是
| A.HNO2非常不稳定,其分解产物为NO和H2O |
| B.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解 |
| C.HNO2的酸性弱于碳酸的酸性 |
| D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应 |
已知2Al+2NaOH+2H2O 2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA |
| B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA |
| C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA |
| D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA |
将氯化铵固体溶解在D2O(重水)中,反应的离子方程式正确的是
A.NH4+ + D2O  NH3·D2O + H+ NH3·D2O + H+ |
B.NH4+ + D2O  NH3·HDO + D+ NH3·HDO + D+ |
C.NH4+ + 2D2O  NH3·HDO + D3O+ NH3·HDO + D3O+ |
D.NH4+ + 2D2O  NH3·D2O + HD2O+ NH3·D2O + HD2O+ |