为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。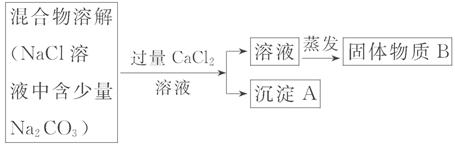
(1)写出沉淀A的化学式 。
(2)加入CaCl2溶液后,分离除去沉淀A的实验操作和蒸发所共同用到的一种玻璃仪器是 。
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质B的成分 (用化学式表示)。
(4)同学继续探究后又提出新的方案:将混合物溶解,若滴加过量盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。写出有关反应的化学方程式: 。
(5)你认为物质B中是否含有杂质氯化氢 (填“是”或“否”),理由是 。
写出下列反应的化学方程式,并求各物质的质量比。
(1)氢氧化钠(NaOH)溶液和硫酸铜(CuSO4)溶液反应,产生氢氧化铜沉淀[Cu(OH)2],生成的硫酸钠(Na2SO4)留在溶液中。;
(2)白磷在空气中燃烧,生成五氧化二磷。;
(3)甲烷(CH4)燃烧生成二氧化碳和水。;
下图是鲁教版八年级教材中常见的实验。请根据图示回答下列问题:
(1)试写出上述四个实验中发生反应的化学方程式:
| A.; | B.; |
| C.; | D.。 |
(2)对比这四个化学反应方程式,你会发现它们之间有好多相同之处,请写出四条:
①; ②;
③; ④。
(3)实验室通常用过氧化氢溶液和二氧化锰来制取氧气,请你写出该反应的化学方程式;从该反应中我们能够获取很多信息,请你任写三条:
①;
②;
③。
酒精(学名乙醇)是一种绿色能源,它在空气中完全燃烧生成二氧化碳和水。则酒精中一定含有元素和元素,可能含有元素。
书写化学方程式应遵循两个原则,填写下面两个化学方程式错误的原因。
(1)Cu+O2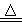 CuO2违背了;
CuO2违背了;
(2)H2O H2↑+O2 ↑违背了。
H2↑+O2 ↑违背了。
饺子是中国传统食品,是吉祥幸运的象征,小明通过观察妈妈包饺子联想到了许多化学知识。
(1)调馅时使用铁强化酱油,酱油中加铁是为了防止。
(2)饺子煮熟后关闭燃气阀门,此操作运用的灭火原理是。
(3)用漏勺捞饺子与化学基本操作中的原理相似。