下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量/kJ |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是 。
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是 。
A.HCl B.HBr C.HI
(3)X2+H2 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答: ,你的根据是 ______________________。
海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法___________________(填序号)。
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。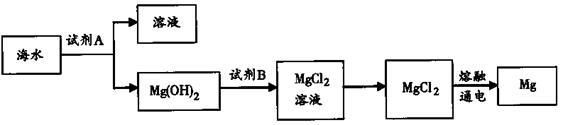
①试剂B是________(填化学式)。
②由无水MgCl2制取Mg的化学方程式是________________________。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示: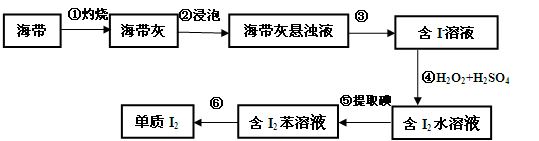
I:下列不属于步骤①操作所用的仪器是 ________(填序号)。
A.酒精灯 B.漏斗C.坩埚 D.泥三角
II:步骤③的实验操作名称是__________。
III:④步骤反应的离子方程式________。
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法。
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: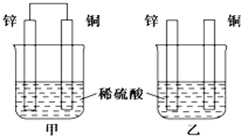
(1)上图两装置中能构成原电池的是(填甲或乙)。
(2)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子的物质的量为。
(3)现有如下两个反应:A:NaOH+HCl=NaCl+H2O ;B:Fe+2Fe3+= 3Fe2+,根据两反应的本质,判断不能设计成为原电池(填A或B),不能的原因是。
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为_____________。
②0~10s内,用Z表示的化学反应速率____________。
③X的转化率为________________。
(2)向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:


下列有关说法不正确的是()
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间生成a mol O2,同时生成2a mol SO2时,反应达到平衡状态 |
| D.SO2和O2的转化率相等 |
下表是元素周期表的一部分,根据要求回答下列问题。
| A |
|||||||||||||||||
| E |
F |
J |
H |
||||||||||||||
| B |
D |
I |
G |
||||||||||||||
| C |
K |
||||||||||||||||
(1)元素I位于周期表中的位置。
(2)B、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是_______(填化学式)。
(3)H、K、G三种元素对应的氢化物中热稳定性最强的是________(填化学式)。
(4)某离子化合物只含有A、F、J三种元素,该化合物是(填化学式)。
(5)写出D元素最高价氧化物与B元素最高价氧化物对应水化物反应的离子方程______。
选做(15分)【选修3:物质结构与性质】
Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。请回答下列问题:
(1)基态Fe3+的电子排布式可表示为。
(2)与CN-互为等电子体的分子有(写出2种)。
(3)金属配合物Fe(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=。
Ⅱ.已知氮化铝的晶胞结构如图所示。请回答下列问题: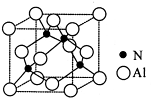
(4)下列说法正确的是__________(填序号)。
| A.氮化铝晶胞结构与NaCl相同 | B.第一电离能 N>Al |
| C.电负性N>Al | D.原子半径 N>Al |
(5)NH3空间构型为;已知(CH3)3Al为非极性分子,则其中铝原子的杂化方式为。
(6)若氮化铝可由(CH3)3Al和NH3在一定条件下反应制得,则反应的方程式为。
(7)若Al与N 原子最近的距离为a cm,则该晶体的密度为g/cm。(阿伏加德罗常数用NA表示)