已知:HCN(aq)与NaOH(aq)反应生成1 mol水的ΔH="-12.1" kJ·mol-1;HCl(aq)与NaOH(aq)反应生成1 mol水的ΔH="-57.3" kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)==2H2O(l)ΔH ="-571.6" kJ/mol
2CO(g)+O2(g)==2CO2(g)ΔH ="-566" kJ/mol
CH4(g)+2O2(g)==CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的燃气,理论上所获得的热值后者大约是前者的多少倍()
| A.0.8 | B.1.3 | C.1.6 | D.3.1 |
已知:
(1)H2(g)+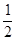 O2(g)==H2O(g)ΔH1 =a kJ·mol-1
O2(g)==H2O(g)ΔH1 =a kJ·mol-1
(2)2H2(g)+O2(g)==2H2O(g)ΔH2 =b kJ·mol-1
(3)H2(g)+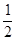 O2(g)==H2O(l)ΔH3 =c kJ·mol-1
O2(g)==H2O(l)ΔH3 =c kJ·mol-1
(4)2H2(g)+O2(g)==2H2O(l)ΔH4 =d kJ·mol-1
下列关系式中正确的是()
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
已知化学反应2C+O2 2CO,2CO+O2
2CO,2CO+O2 2CO2都是放热反应,据此判断下列说法不正确的是()
2CO2都是放热反应,据此判断下列说法不正确的是()
| A.12 g碳所具有的能量一定高于 28 g CO所具有的能量 |
| B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| C.12 g C 和32 g O2所具有的总能量大于44 g CO2所具有的总能量 |
| D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ热量,表示上述反应的热化学方程式正确的是()
A.C8H18(l)+ O2(g)==8CO2(g)+9H2O(g) ΔH ="-48.40" kJ·mol-1 O2(g)==8CO2(g)+9H2O(g) ΔH ="-48.40" kJ·mol-1 |
B.C8H18(l)+ O2(g)==8CO2(g)+9H2O(l)ΔH="-5" 518 kJ·mol-1 O2(g)==8CO2(g)+9H2O(l)ΔH="-5" 518 kJ·mol-1 |
C.C8H18(l)+ O2(g)==8CO2(g)+9H2O(l) ΔH ="+5" 518 kJ·mol-1 O2(g)==8CO2(g)+9H2O(l) ΔH ="+5" 518 kJ·mol-1 |
D.C8H18(l)+ O2(g)==8CO2(g)+9H2O(l) ΔH ="-48.40" kJ·mol-1 O2(g)==8CO2(g)+9H2O(l) ΔH ="-48.40" kJ·mol-1 |
对于放热反应2H2+O2 2H2O,下列说法正确的是( )
2H2O,下列说法正确的是( )
| A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 |
| B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 |
| C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 |
| D.反应物H2和O2具有的能量相等 |