在密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
| A.X2为0.3 mol·L-1,Y2为0.9 mol·L-1 | B.Y2为1.0 mol·L-1 |
| C.X2为0.3 mol·L-1,Z为0.2 mol·L-1 | D.Z为1.0 mol·L-1 |
右图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是()
| A.两条曲线间任意点均有c(H+)×c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是()
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= 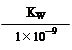 mol·L—1
mol·L—1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO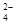 ,浓度均为0.010mol •L-1,向该溶液中逐滴加入0.010 mol •L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
,浓度均为0.010mol •L-1,向该溶液中逐滴加入0.010 mol •L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A.Cl-、Br-、CrO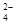 |
B.CrO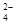 、Br-、Cl- 、Br-、Cl- |
C.Br-、Cl-、CrO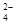 |
D.Br-、CrO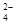 、Cl- 、Cl- |
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是()
| A.W2-、X+ | B.X+、Y3+ |
| C.Y3+、Z2- | D.X+、Z2- |
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-] )与pH的变化关系如图所示,则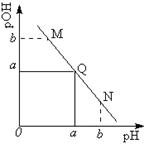
| A.M点所示溶液导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)﹥c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |