室温下,某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定不能大量存在的是( )
| A.Cl- | B.HCO3— | C.Na+ | D.NO3— |
下列说法正确的是
| A |
B |
C |
D |
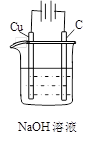
| 通电一段时间后,搅拌均匀,溶液的pH不变 |
乙电极上的电极反应:2H++2e-=H2↑ |
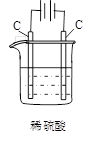
电解初期总反应: Cu+2H+ Cu2++H2↑ |
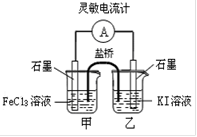
盐桥中的K+移向KI溶液 |
 |
 |
 |
 |
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是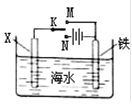
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |
已知反应:H2(g)+ O2(g)=H2O(g)△H1
O2(g)=H2O(g)△H1 N2(g)+O2(g)=NO2(g)△H2
N2(g)+O2(g)=NO2(g)△H2  N2(g)+
N2(g)+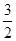 H2(g)=NH3(g)△H3
H2(g)=NH3(g)△H3
则反应2NH3(g)+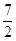 O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
| A.2△H1+2△H2-2△H3 | B.△H1+△H2-△H3 |
| C.3△H1+2△H2+2△H3 | D.3△H1+2△H2-2△H3 |
已知:H2(g)+F2(g)=2HF(g)△H=-539kJ/mol,若断裂1mol H—H键需吸收436kJ的能量,断裂1mol F—F键需吸收155kJ的能量,则断裂1 mol H—F键需吸收的能量为
| A.565kJ | B.282.5kJ | C.765kJ | D.380kJ |
已知反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,下列各组实验中最先出现浑浊的是
| 组号 |
温度 |
Na2S2O3 |
H2SO4 |
H2O |
||
| 体积 |
浓度 |
体积 |
浓度 |
体积 |
||
| A |
0℃ |
10mL |
0.1 mol/L |
10mL |
0.1 mol/L |
0mL |
| B |
10℃ |
5mL |
0.1 mol/L |
5mL |
0.1 mol/L |
10mL |
| C |
30℃ |
5mL |
0.1 mol/L |
5mL |
0.1 mol/L |
10mL |
| D |
30℃ |
5mL |
0.2 mol/L |
5mL |
0.2 mol/L |
10mL |