为测定气球内的气体成分,有的学生用超薄的气球按如图装置进行实验。开始时气球沉于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内盛放的气体可能是( )
| A.O2 | B.H2 | C.NH3 | D.SO2 |
右图为反应2SO2+O2 2SO3的速率v(SO2)变化的图像,则横坐标可能是
2SO3的速率v(SO2)变化的图像,则横坐标可能是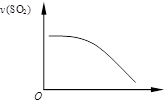
| A.反应时间 | B.温度 |
| C.压强 | D.SO2的浓度 |
爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
①放电时,Fe参与负极反应,NiO2参与正极反应
②充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-=" Fe" + 2OH-
③放电时,电解质溶液中的阴离子向正极方向移动
④放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
| A.只有③ | B.③④ | C.④⑤ | D.①②⑤ |
对下列实验的描述正确的是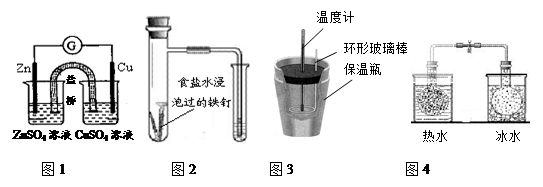
| A.图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 |
| B.图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C.图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g) N2O4(g)是吸热反应 N2O4(g)是吸热反应 |
右图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述不正确的是
A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g) ΔH = -92kJ·mol-1 2NH3(g) ΔH = -92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的活化能和反应热都改变 |
| D.在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2molN2和6molH2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
铅蓄电池的电极材料是Pb和PbO2,电解液是硫酸溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B.电解池的阳极反应式为:4OH-- 4e-==2H2O + O2↑ |
| C.电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D.蓄电池中每生成2molH2O,电解池中就消耗1molH2O |