下列工业生产中,各物质的物质的量间的关系式不正确的是( )
| A.制漂白粉:2Cl2~Ca(ClO)2 |
| B.制H2SO4:FeS2~2H2SO4 |
| C.合成氨:C~H2~2/3NH3 |
| D.制HNO3:NH3~HNO3 |
下列有关元素周期表的叙述正确的是()
| A.元素周期表是元素周期律的具体表现形式 |
| B.半导体材料可在周期表中氟、氯、硫等元素的位置附近寻找 |
| C.在周期表中金属和非金属的分界处寻找耐高温耐腐蚀的合金材料 |
| D.在过渡元素中寻找制造农药的元素 |
在一定条件下,可逆反应A(g)+3B(g) 4C(g)达到平衡时,下列叙述正确的是()
4C(g)达到平衡时,下列叙述正确的是()
A.此时反应物B全部转化成了生成物
B.单位时间内生成n mol A,同时生成3n mol B
C.若改变条件,A、B、C的浓度有可能再变化
D.A、B、C的分子数比为1:3:4
将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的虚线所示。其中正确的是()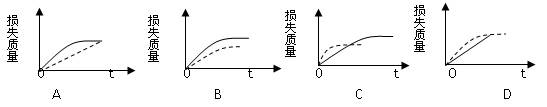
“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外现象冰。1体积“可燃冰”可贮载100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是 ( )
| A.“可燃冰”有可能成为人类未来的重要能源 |
| B.“可燃冰”是一种比较洁净的能源 |
| C.“可燃冰”提供了水可能变成油的例证 |
| D.“可燃冰”的主要可燃成份是甲烷 |
有人认为人体实际上是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断的补充“燃料”。按照这种观点,你认为下列物质不能看作“燃料”的是()
| A.淀粉类物质 | B.水 | C.脂肪类物质 | D.蛋白质 |