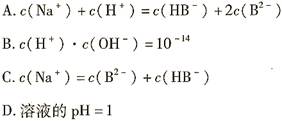在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )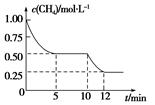
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
下列比较中,正确的是
| A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 |
| B.0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+) >c(OH-)>c(H+) |
| C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
| D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
已知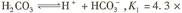
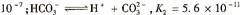 ;
;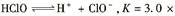


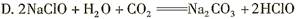
有关常温下pH均为3的醋酸和硫酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
一定能在下列溶液中大量共存的离子组是
| A.水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+、Na+、C1-、HCO3- |
| B.含有大量Fe3+的溶液:SCN-、I-、K+、Br- |
| C.能使pH试纸变蓝色的溶液:Na+、S2-、CO32-、AlO2- |
| D.澄清透明的无色溶液:CIO-、MnO4-、A13+、SO42- |
室温下,0.1mol·L-1的NaHB溶液中c(H+)>c(OH-)。则下列关系中一定正确的是