已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题: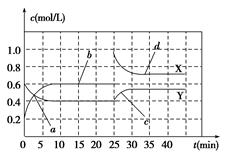
(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。
(1)实验室制备ClO2的方法之一为:
2KClO3+H2C2O4+H2SO4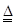 2ClO2↑+K2SO4+2CO2↑+2H2O(H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是________。
2ClO2↑+K2SO4+2CO2↑+2H2O(H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是________。
| A.KClO3在反应中得到电子 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 |
| D.1 mol KClO3参加反应有2 mol电子转移 |
(2)KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯。其变化可表示为2KClO3+4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O
①浓盐酸在反应中表现出来的性质是__________________________________________;
②已知每产生0.1 mol Cl2,则发生转移的电子的物质的量为0.2 mol。ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的________倍。
含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是(填离子符号,下同)
(2)向③中加入NaOH溶液,现象是有关化学方程式为
(3)加入过量NaOH溶液无沉淀的是__________________
(4)加铁粉溶液质量增重的是,溶液质量减轻的
(5)遇KSCN溶液呈红色的是
(6)能用来鉴别Cl–存在的离子是
由硫可得多硫化钠Na2Sx,x值一般为2~6,已知Na2Sx与NaClO反应的化学方程式如下: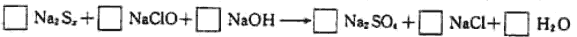
试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
据考证,商代炼铜,主要矿物原料是孔雀石,主要燃料是木炭,冶炼温度估计在1000 ℃左右,可能涉及的反应有:①Cu2(OH)2CO3 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
②2CuO+C 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO Cu+CO2
Cu+CO2
④CO2+C 2CO
2CO
(1)从四种基本反应类型看,①②④分别属于________、________、________。
(2)在上述反应中,属于氧化还原反应的是__________(填序号)。
铁单质及其化合物在生产、生活中应用广泛.请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为
________________________________________________________________________.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是_______________________________
_________________________________________________________(用离子方程式表示).
在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是_____________
________________________________________________________________________.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是____________.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母).
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
Ⅰ对;Ⅱ对;无 |
| C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
Ⅰ错;Ⅱ对;无 |
| D |
在空气中铁的表面能形成致密的氧化膜 |
铁不能与氧气反应 |
Ⅰ对;Ⅱ对;有 |