已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ;若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填选项) 。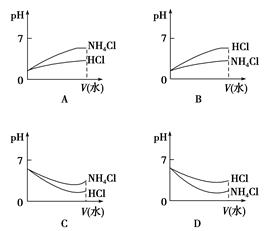
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
 在一定体积的密闭容器中,进行如下化学反
在一定体积的密闭容器中,进行如下化学反 应:
应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) 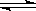 C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的
量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x=mol.
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
mol.
等物质的量A、B、C、D四种物质混合,发生如下反应: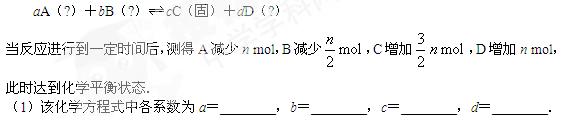
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是
________反应(填“放热”或“吸热”)
Ⅰ。(每空1分,共4分)⑴通常状况下,甲同学取1 mol H2O加热到100℃时,液态水会汽化为水蒸气(如图所示),该过程属于变化。
在保持压强不变的情况下,水蒸气的体积
(填“>”、“<”或“=”)22.4L。
⑵乙同学做H2在O2中燃烧的实验,该实验过程属于变化,在该变化过程中,一定保持相等的是(填序号)。
| A.反应物分子数目与生成物分子数目 | B.反应物原子总物质的量与生成物原子总物质的量 |
| C.反应物总质量与生成物总质量 | D.反应物体积与生成物体积 |
Ⅱ。(每空1分,第3小题2分,共6分)如图所示为常见仪器的部分结构。
⑴请写出下列仪器的名称: A ,B ,C 。
⑵仪器B上标记有(填序号)。
①质量②温度 ③刻度线④浓度⑤容积
③刻度线④浓度⑤容积
⑶检验仪器B是否漏水的方法是
包括4小题,(每空1分,第4小题2分,共10分)
(1)1mol H2SO4中约含有个H2SO4,mol H ,mol O
(2)9.03×1023个CO2的物质的量是mol,在标准状况下的体积L,质量是是克。
(3)在100mL2mol/LH2SO4溶液中,H2SO4的质量是克。H+的物质的量浓度为。
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为。