碘海醇是一种非离子型X-CT造影剂。下面是以化合物A(分子式为C8H10的苯的同系物)为原料合成碘海醇的合成路线[R-为-CH2CH(OH)CH2OH]: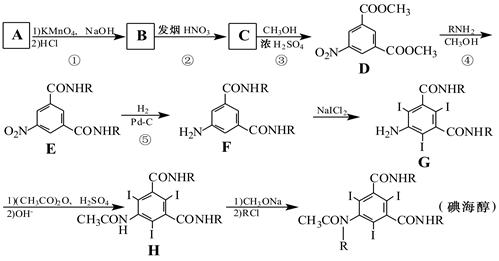
(1)写出A的结构简式: 。
(2)反应①→⑤中,属于取代反应的是 (填序号)。
(3)写出C中含氧官能团的名称:硝基、 。
(4)写出同时满足下列条件的D的两种同分异构体的结构简式: 。
Ⅰ.含1个手性碳原子的α-氨基酸;
Ⅱ.苯环上有3个取代基,分子中有6种不同化学环境的氢;
Ⅲ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应。
(5)已知:
①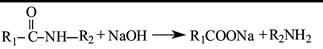
②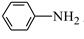 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以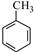 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体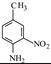 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:H2C=CH2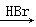 CH3CH2Br
CH3CH2Br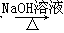 CH3CH2OH
CH3CH2OH
(16分)FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/LFeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
I.某一反应体系中有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:____________ __。
(4) 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+===Mn2++4H2O ①
MnO4-+3e-+2H2O===MnO2↓+4OH-②
MnO4-+e-===MnO42-(溶液绿色) ③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
①________KMnO4+________K2S+______( )===
________K2MnO4+________K2SO4+________S↓+______( )。
②若生成6.4g单质硫,反应过程中转移电子的物质的量为________。
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、S2-、 Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题: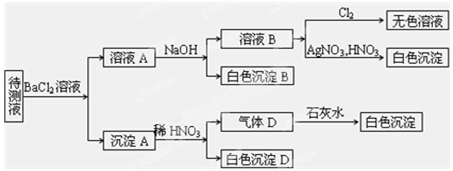
(1)待测液中是否含有SO42-、SO32-:___________________。
(2)沉淀B的化学式为_________;生成沉淀B的离子方程式为____ __。
(3)根据以上实验,待测液中肯定没有的离子是__________;肯定存在的离子还有________。
I、(1)下列物质中属于强电解质的是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质的是 。(填序号)
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(要求配平)
(2)反应中,被还原的物质是 ,Cr2(SO4)3是 剂。
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 。
(8 分)A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
(1)若A 是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环中的一种重要物质.则B的化学式是________,C和D反应生成A的化学方程式是_____________。
(2)若A是无色液体,D是一种黑色固体,则C的化学式是_______,由B生成D的化学方程式为____。
(3)若A是碳酸氢钠,且已知碳酸氢钠受热可分解为碳酸钠、二氧化碳和水,写出过量的气体C与D溶液反应生成A的化学方程式 。