催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。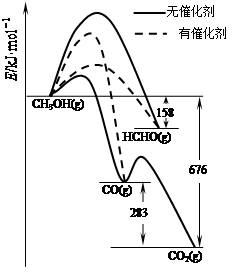
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O="2n" CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
(6 分)写出用 H、C、O、Na 四种元素组成符合下列要求的物质的化学式
(1)密度最小的气体___________;
(2)天然气的主要成分_________;
(3)固体可用于冷藏食物和人工降雨的物质________;
(4)实验室用于制取氧气的物质___________;
(5)俗名为烧碱的物质___________;
(6)用于治疗胃酸过多的药物__________。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。 (1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。
(1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。 a.NaOHb.Znc.Fed.NH3·H2O
a.NaOHb.Znc.Fed.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 __________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
__________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
(11分) 已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如下表所示。
| 元素 |
原子结构特征或有关物质的性质 |
| A |
原子的最外层电子数是其内层电子数的2倍 |
| B |
其单质是空气中含量最多的物质 |
| C |
原子的最外层电子数是其电子层数的4倍 |
| D |
位于第ⅡA族,其原子半径比E的大 |
| E |
是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F |
原子序数16,其单质在通常状况下为固体 |
| G |
原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是_________。这七种元素中,不属于主族元素的元素的名称是 。
(2)在E、F、G三种元素中,原子半径最小的是 (填元素符号)。
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为 ,分子的空间结构为 。A与氧元素可形成化合物AO2,该化合物分子的电子式为 。
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈 (填“酸”、“碱”或“中”)性,原因为________(用方程式表示)
已知下列反应:①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2③Cl2+H2O=HCl+HClO
④2NaCl+2H2O通电2NaOH+H2↑+ Cl2↑⑤CaO+H2O=Ca(OH)2⑥CaCO3+H2O+CO2=Ca(HCO3)2
(1)其中水在反应中作氧化剂的反应是(填代号下同) 。
(2)其中水在反应中作还原剂的反应是 。
(3)其中水在反应中既不作氧化剂也不作还原剂的反应是 。
过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。
已知:温度过高过氧化钙会分解生成氧化物和氧气。
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下: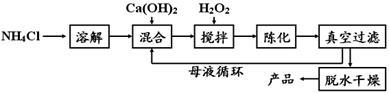
【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
(1)方法1中搅拌的目的是 ;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2 + H2O2
+ 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl;制备过程中除水外可循环使用的物质是 (填化学式)。
(2)方法2中气体X是 ,实验室常用 溶液来检验;煅烧后的反应是化合反应,也能生成CaO2·8H2O,反应的化学方程式为 ;该反应需控制温度在0~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 。
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。