明矾[化学式为KAl(SO4)2·12H2O]是一种常用的净水剂。小华同学为了探究明矾的净水原理,进行了如下实验探究:
【提出问题】明矾为什么能够净水?
【查阅资料】材料一:净水原理是,净水剂具有较大表面积或者净水剂粒子与水反应生成表面积较大的物质,把水中的细小漂浮颗粒吸附到表面,使其密度加大并下沉。
材料二:明矾[KAl(SO4)2·12H2O]在水溶液中可以解离出K+、Al3+、SO42-。
【提出猜想】猜想1:K+能与水反应产生表面积较大的物质。
猜想2:Al3+能与水反应产生表面积较大的物质。
猜想3:SO42-能与水反应产生表面积较大的物质。
猜想4:K+、Al3+、SO42-均能与水反应产生表面积较大的物质。
【完成实验】
| 实验 序号 |
水样(稍浑浊) 体积(mL) |
实验操作 |
观测 时间 |
实验现象 |
| ① |
20 |
向水样中加入KCl溶液 |
5分钟 |
仍浑浊 |
| ② |
20 |
向水样中加入Na2SO4溶液 |
5分钟 |
仍浑浊 |
| ③ |
20 |
向水样中加入Al2(SO4)3溶液 |
5分钟 |
变澄清 |
| ④ |
20 |
向水样中加入AlCl3溶液 |
5分钟 |
变澄清 |
【得出结论】实验 证明SO42-无净水作用,实验 证明K+无净水作用;
猜想 成立。
【交流反思】(1)小芳同学认为实验①和④是多余的,你 (填“支持”或“不支持”)她的观点,理由是 。
(2) (填“能”或“不能”)把实验③省去。
(3)小莉同学联想到自来水的生产过程中会用到活性炭去除水中异味,他认为活性炭的作用原理与明矾相同,你同意她的观点吗?[注意:若答对本小题奖励4分,化学试卷总分不超过60分。]
(填“同意”或“不同意”),理由是 。
为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验.
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光.
【实验二】取粗细、长短相同的锌丝、铜丝、镍丝均与50mL稀盐酸反应,实验记录如下:
| 锌 |
铜 |
镍 |
铜 |
|
| 稀盐酸的质量分数 |
3% |
3% |
15% |
15% |
| 反应现象 |
少量气泡 |
无现象 |
许多气泡 |
无现象 |
【实验三】金属锌、铜和稀盐酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光.
(1)实验一的现象说明三种金属都具有性.
(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式是,铜不能与稀盐酸发生化学反应的原因是,在金属活动性顺序中排在氢的后面
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是.
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变.下列关于实验三分析正确的是(填选项).
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能.
实验室利用如图装置进行组合,制取并收集氧气。

(1)写出标注仪器的名称:a,b
(2)若选择①与⑤组合制取并收集氧气,反应的化学方程式是,实验结束时,应先,再停止加热.
(3)制取并收集干燥的氧气,下列组合可行的是(填选项,可多选).
| A. | ①③④ | B. | ②③④ | C. | ①③⑤ | D. | ②③⑤ |
(4)选择装置②制氧气,分液漏斗盛装的药品是 过氧化氢溶液.
如图1所示是氢氧化钠溶液与盐酸反应的实验研究。
(1)未滴加盐酸时,烧杯中溶液呈色.
(2)随着盐酸不断滴入,烧杯中溶液的pH逐渐(填"增大"、"减小"或"不变"),该反应的化学方程式是
(3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图2所示.某时刻测得溶液的温度是32℃,请判断b点时溶液的酸碱性并说明理由
(4)当溶液的温度为38℃时,可证明溶液不含氢氧化钠的实验方法是(填选项)
A.品尝烧杯中溶液的味道
B.用手沾取烧杯中溶液并体验是否有滑腻感
C.往烧杯中再滴加少量氢氧化钠溶液并观察溶液颜色
"鱼浮灵"主要成分是过碳酸钠(
).俗称固体双氧水.某兴趣小组对其进行以下探究:
【实验探究一】过碳酸钠的性质探究
(1)取少量"鱼浮灵"于试管中,加适量的水,有持续细小气泡缓慢放出;向试管中加入少量
粉末,产生大量气泡.将带火星的木条伸入试管,木条复燃,说明有(填化学式)生成。
(2)取实验(1)中上层清液,测得溶液
;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清的石灰水中,出现浑浊现象,说明有二氧化碳生成.写出二氧化碳与澄清石灰水反应的化学方程式。
结论:过碳酸钠具有
和双氧水的双重化学性质.
【实验探究二】"鱼浮灵"样品的组成测定
利用如图所示装置进行"鱼浮灵"样品中活性氧含量测定和过碳酸钠(
)组成的测定(杂质对测定无影响)。
查阅资料:
①活性氧含量是指样品中能转化为氧气的氧元素的质量分数."鱼浮灵"中活性氧含量
是一等品,
活性氧含量
是合格品.
②过碳酸钠能与酸反应放出二氧化碳和氧气.
(3)实验前先缓慢通入
一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至
中样品完全反应;继续缓慢通
.实验前先缓慢通入
一段时间的目的是。
(4)装置
的作用(填字母代号)。
| A. |
除去气体中水蒸气 |
B. |
便于观察和控制气流速度 |
(5)若没有装置 ,会导致 的值(填"偏大"或"偏小")。
(6)实验测得
装置中铜网增重
,D装置增重
.该产品中活性氧含量为(计算结果精确到
);属于(填"一等品"或"合格品");
。
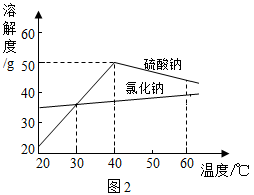
是制造纸张、药品、染料稀释剂等的重要原料.某
样品中含有少量
和
,实验室提纯
的流程如图1所示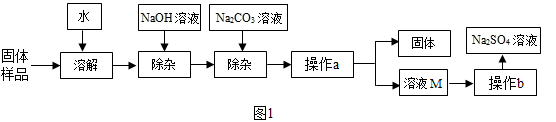
(1)加入
溶液可除去的阳离子是(填离子符号),其反应的化学方程式为:.若添加的
溶液和
溶液过量,可加入适量(填名称)除去.
(2)操作a的名称是,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、.
(3)溶液M中的溶质是
和杂质
,观察图2中溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤.降温结晶的最佳温度范围是℃以下,因为
溶解度