为了解决环境因素对维生素C含量的影响,从而更好地保存有关食物,某兴趣小组同学根据维生素C可使高锰酸钾(KMnO4)溶液褪色的原理,进行了如下表所示的实验。
| 编号 |
维生素C溶液的处理方法 |
使40毫升高锰酸钾(KMnO4)溶液褪色的滴数 |
| 1 |
放置于室内暗处0.5小时 |
15 |
| 2 |
阳光强烈直射5小时后,放置于室内暗处0.5小时 |
22 |
| 3 |
煮沸10分钟后,放置于室内暗处0.5小时 |
21 |
(1)他们探究了 对维生素C含量的影响。
(2)他们的探究对我们的启示是:在贮存富含维生素C的食物时,应 ,以防止其中的维生素C过量流失,降低食物的营养价值。
(3)为了解维生素C的化学性质,他们用pH试纸测得该维生素C溶液的pH在1至2之间,说明维生素C具有 性。
(1)甲同学为探究“物质燃烧的条件”,同时点燃小木条和小煤块,发现小煤块点燃所需时间长,原因是。
(2)乙同学在点滴板的空穴中滴加氢氧化钠溶液,再滴加无色酚酞试液,观察现象。用白色点滴板代替试管进行相关实验的优点是(一点即可)。
(3)根据下图所示制取气体的装置,回答下列问题(装置选择用序号填写):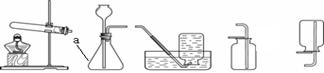

①a仪器的名称是。
②用石灰石和稀盐酸制取二氧化碳时,选用的发生和收集装置是,反应的化学方程式为。
③加热高锰酸钾制取氧气,反应的化学方程式为;如用C装置收集氧气,观察到,表示氧气已满;反应完成后,要从剩余固体中回收二氧化锰,应进行溶解、、洗涤干燥等操作。
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对固体沉淀的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由:(用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈碱性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4•5H2O CuSO4 + 5H2O↑;
CuSO4 + 5H2O↑;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:将反应后的固、液混合物经过滤、洗涤、室温晾干得蓝色固体。
Ⅱ.定性探究固体的成分:
用下图所示方案,进行实验,并得到下列现象:
(1)上图中无色气体为,所以猜想二不成立。
(2)向蓝色溶液中加入足量的铁屑,实验现象为,。
发生反应的方程式为、。
Ⅲ.定量测定固体的组成: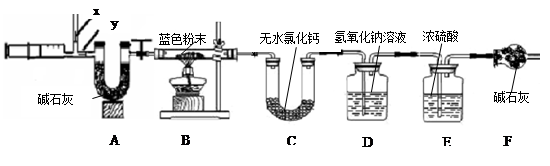
设固体为Cu(OH)2•CuCO3•XH2O,为测定其组成,称取24.0 g蓝色固体。继续进行实验:
图中注射器处为两个单向阀:推注射器时x关闭,y处打开;拉注射器时,x打开进空气,y关闭。
实验步骤:①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处玻璃管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量。
问题探究:
(3)进行步骤⑤的操作中,注射器活塞要缓缓推动的主要目的是。
数据处理:
(4)某兴趣小组利用上述方法,测得以下数据:(假定每步反应都完全)
| B |
C |
D |
E |
F |
|
| 反应前 |
124.0g |
250.0g |
300.0g |
350.0g |
360.0g |
| 反应后 |
116.0g |
253.6g |
304.4g |
350.1g |
360.0g |
E装置质量增加的原因是;
通过计算确定固体化学式中的X的值。
计算过程:
以下是实验室制取氧气的装置图,请按要求回答下列问题.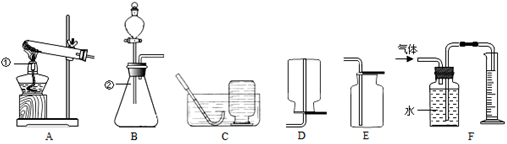
⑴写出图中标号仪器的名称:① 。
⑵实验室用氯酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是 (填字母
序号,下同)。
⑶实验室用H2O2溶液和MnO2混合制氧气,该反应的化学方程式为 。
同学们利用B和F装置,通过排水量来测定生成氧气的体积,反应结束后,发现量筒内
|
收集到的水的体积总是比理论值偏大(水的体积测量准确),其主要原因是 。
⑷若用如图所示医用塑料袋排空气法收集H2,则H2导入端为 (填“a”或“b”)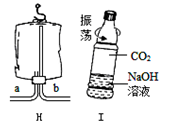
小强学习了金属活动顺序后,觉得非常神奇和有趣,刚好有一次机会到化学实验室做实验,他决定自己做一个探究实验。
(1)他猜想:假如将金属钠放入到硫酸铜溶液中,能不能把铜置换出来呢?
假如他的猜想正确,反应的化学方程式为:,
实验的现象为(写两点)。
(2)进行实验:他将保存在煤油中的金属钠用镊子取出,用滤纸吸干表面的煤油,然后用小刀将金属钠切下绿豆大小的一块放入到装有100mL5%硫酸铜溶液的250mL烧杯中,在烧杯口盖上一块玻璃片,观察到金属钠在溶液表面剧烈反应,四处游动,有“嘶嘶”声,熔化并燃烧,有轻微爆炸声,反应完毕后观察到溶液中有蓝色絮状沉淀和少量黑色固体。
(3)为什么会得到与猜想不同的实验现象呢?小强通过查阅资料知道:金属钠的化学性质非常活泼,能与水反应生成一种可燃性气体和另一种能使无色酚酞变红的物质,同时放出大量的热;氢氧化镁受热时能分解生成两种氧化物,其它难溶的氢氧化物也有类似的化学性质。
(4)分析与小结:小强通过资料并结合实验现象,认为该实验过程中可能发生了三个化学反应,请依次写出反应的化学方程式,,
。
(5)反思与交流:通过(2)可知金属钠有什么物理性质(写出一点即可)?。
金属钠为什么要保存在煤油中(写出一点即可)?。
根据下列装置图填空: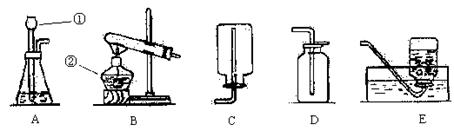
(1)写出编号①、②仪器的名称:①________________;②________________。
(2)实验室制取二氧化碳的发生装置应选用___________(填序号,下同),收集装置应选用___________;若在实验室用加热高锰酸钾的方法制取氧气,反应的化学方程式为___________,如果收集的氧气要用于验证蜡烛燃烧产物的实验,收集装置应选用___________。