(1)甲同学为探究“物质燃烧的条件”,同时点燃小木条和小煤块,发现小煤块点燃所需时间长,原因是 。
(2)乙同学在点滴板的空穴中滴加氢氧化钠溶液,再滴加无色酚酞试液,观察现象。用白色点滴板代替试管进行相关实验的优点是 (一点即可)。
(3)根据下图所示制取气体的装置,回答下列问题(装置选择用序号填写):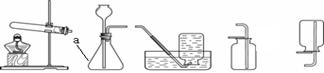

①a仪器的名称是 。
②用石灰石和稀盐酸制取二氧化碳时,选用的发生和收集装置是 ,反应的化学方程式为 。
③加热高锰酸钾制取氧气,反应的化学方程式为 ;如用C装置收集氧气,观察到 ,表示氧气已满;反应完成后,要从剩余固体中回收二氧化锰,应进行溶解、 、洗涤干燥等操作。
暖宝宝是一种防寒用品,如图所示,暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?剪开内包装袋,倒出其中的粉末,发现呈黑色.
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中一种或几种.
【初步验证】将磁铁靠近黑色粉末,部分被吸引.
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引.
【得出结论】该黑色粉末可能含有 .
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
| ② |
取实验①的残渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末肯定含 ,肯定不含 .写出实验①的化学反应方程式 .
由实验②可知,该黑色粉末肯定含 .
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量.由此可见,人们可以利用化学反应放出的能量,请再举一例: .
某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与.
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙.
猜想②:氢氧化钙溶液可能部分变质,其成分是 .
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取样于试管中,滴加稀盐酸 |
有 生成 |
原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 |
溶液成红色 |
原溶液一定有 |
【实验结论】综合上述实验(1)、(2),你得出的结论是猜想 成立.
【反思拓展】(1)氢氧化钙露置于空气中容易变质,原因是 (用化学方程式表示).
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是 .
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
一、配置30℃时的硫酸铜饱和溶液:
(1)配置的步骤如图:
取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
(2)在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10),得到晶体后还要继续加热,直至固体颜色变为(11)色为止。此操作过程中,用到的仪器除铁架台、酒精灯外,还需(12)。
(3)最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13)g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14)(写出一条即可);
(4)测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验方法中一定还要用到的实验操作是(15)(填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
为控制大气中“温室效应”(CO2、CH4)气体的排放量,“低碳”正成为人们的共识。
(1)近几十年来大气中二氧化碳含量不断上升的主要原因是。
(2)生活中燃烧等物质的量的碳、一氧化碳、甲烷,最终排放出的二氧化碳的量(选填编号)
| A.一样多 | B.碳多 | C.一氧化碳多 | D.甲烷多 |
(3)CO2常用来做灭火剂,但是遇到特殊物质时,CO2也能支持燃烧,写出镁条在CO2中燃烧的化学方程式,该反应中做还原剂的是。
(4)实验室制取二氧化碳,采用的实验原理用化学方程式表示为;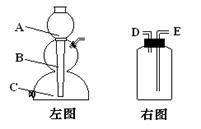
若用左图制取CO2则碳酸钙固体应该放置的位置是,若用右图收集CO2则气体进入的导管口应该是(以上均用图中英文编号填写)。
(5)实验室利用澄清石灰水检验CO2时发生的化学方程式为。
实验室利用H2+CuO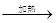 Cu+H2O反应原理(实验装置见下图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气。则有关实验操作说法正确的是
Cu+H2O反应原理(实验装置见下图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气。则有关实验操作说法正确的是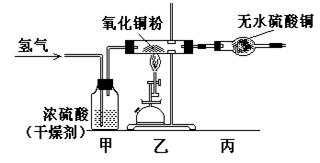
| A.只需要获得氧化铜粉前后的质量差 |
| B.只需要获得无水硫酸铜前后的质量差 |
| C.若没有“甲”装置,所得比值偏大 |
| D.实验中一定要通入足量的氢气将氧化铜完全反应 |