25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① _________________________;
② _________________________;
③ _________________________。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
药物贝诺酯可以水杨酸为原料在一定条件下反应制得,主要反应过程如下:
请回答下列问题:
(1)水杨酸的分子式为:,它的含氧官能团分别名称为:和。
(2)1mol 水杨酸完全燃烧需要消耗mol O2。
(3)水杨酸溶液中加入几滴FeCl3溶液,溶液显色。
(4)反应①的反应类型为:,请写出水杨酸与足量NaOH溶液反应的化学方程式:。
(5)苯胺(C6H5—NH2)与乙酸酐在一定条件下发生类似①的反应,生成乙酰苯胺,试写出该反应的化学方程式:。
我国湖南、广西等地盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:
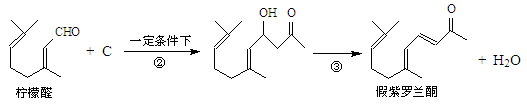

③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式,C的结构简式。
(2)①对应的反应条件是,反应③的反应类型是。
(3)写出B转化为柠檬醛的化学方程式。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式:
。
(5)检验柠檬醛中含有碳碳双键的实验方法是:。
 (6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有种。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有种。
①含有一个苯环②属于醇类且不能发生催化氧化反应
③核磁共振氢谱显示有5个峰
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。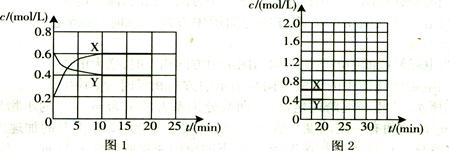
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K=。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)="0.9" mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示: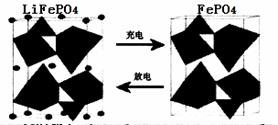
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的极(填“正”或“负”),该电极反应式为。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
某小组进行铝热反应实验,装置如图所示。
(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
| 实 验 步 骤 |
现 象 |
结 论 |
| ①取少量黑色固体于试管中加稀盐酸 |
固体全部溶解,有气泡产生 |
假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 |
溶液不变色 |
【交流评价】
你认为上述结论是否合理,____理由是____。
(3)取上述实验所得溶液,滴人适量氯水溶液变红色。此时涉及的离子反应方程式为
____、____;
利用反应体系中存在的平衡,小组再将溶液均分置于两支试管中并分别编号l、2.进行
如下探究:
| 实验编号 |
实验步骤 |
| 1 |
①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 |
|
| ①滴加4滴1mol/LKSCN溶液 |
|
| ②滴加几滴NaOH溶液 |
该实验中,小组
主要探究的问题是____;
应重点观察的现象是____
预计得出的结论是____。
硝矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O及少量氧化铁。
利用明矾石制备K2SO4的工艺流程如下所示:
(1)焙烧炉中发生如下反应,请在方程式中表示出电子转移的方向和数目
2Al2(SO4)3+3S 2Al2O3+9SO2↑
2Al2O3+9SO2↑
(2)步骤②涉及Al2O3的离子方程式为____。
(3)步骤③调pH生成AI{OH)。的离子方程式为____;不能用CO2来调pH,理由是
.
(4)步骤④的主要操作步骤是____,过滤、洗涤和干燥
(5)炉气回收可做多种用途,请举一例:___。