固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
| A.有O2放电的a极为电池的负极 |
| B.有H2放电的b极为电池的正极 |
C.a极对应的电极反应为O2+2H2O+4e- 4OH- 4OH- |
D.该电池的总反应方程式为2H2+O2 2H2O 2H2O |
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示: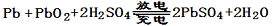
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO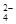 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )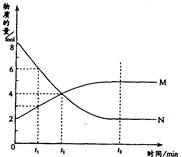
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
已知反应A2(g)+2B2(g)  2AB2(g)的ΔH<0,下列说法正确的是( )
2AB2(g)的ΔH<0,下列说法正确的是( )
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是()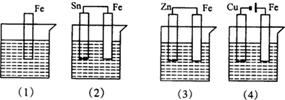
| A.(4)>(2)>(1)>(3) | B.(2)>(1)>(3)>(4) |
| C.(4)>(2)>(3)>(1) | D.(3)>(2)>(4)>(1) |
将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池。已知。通人CH4的一极,其电极反应式是:CH4 + 10OH- - 8e-=CO32-+7 H2O;通入O2的另一极,其电极反应式是:2O2 + 4H2O +8e- = 8OH-。下列叙述不正确的是( )。
| A.通人CH4的电极为负极 |
| B.正极发生氧化反应 |
| C.燃料电池工作时,溶液中的OH-向负极移动 |
| D.该电池使用一段时间后应补充KOH |