铁、铝与冷浓硫酸可发生钝化现象,故工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)m g放入稀硫酸中,铁钉表面现象为 。取出铁钉用蒸馏水洗涤后干燥,置于冷浓硫酸中,10分钟后移入稀硫酸溶液中,观察,开始一段时间铁钉表面无明显变化,其原因是 。
(2)另称取铁钉放入足量冷浓硫酸中,加热,充分反应后,过滤得到、溶液X并收集到气体Y。
①甲同学认为X中除铁单质外外还可能含有Fe3+、Fe2+。若要确认其中的Fe2+,可选择试剂为_________________,现象是_______________________________________________。
②乙同学根据氧化还原反应原理,认为气体中必然含有SO2,取336ml(标准状况)气体Y通入足量溴水中,发生反应离子方程式为:________________________________________。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)加以验证。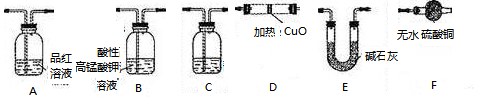
(3)装置的连接顺序是________________________________。
(4)除了C中的现象证明Q存在为,认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)混合气体可能由H2、Q、SO2中的一种或多种气体组成,经测定其含氧量为50%,则该气体可能:①仅由SO2组成;②由H2和Q组成;③由H2和SO2组成;④由Q、SO2组成;⑤由H2、Q和SO2组成;其中可能正确的有( )
| A.① | B.②③④ | C.①②⑤ | D.③④⑤ |
某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。
①应该选用的仪器及装置有(填字母)。
②生石灰与氯化铵反应生成氨气的化学方程式为。
(2)该小组同学设计如图16所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。再选择合适的方案并说明原因。
②检验产物中有NH4+的方法为。
某学业生利用以下装置制备氨气,并完成氨气的喷泉实验。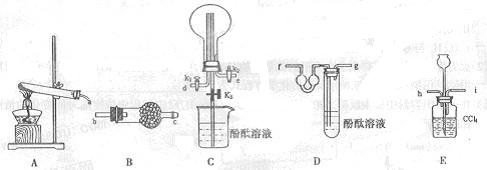
请回答下列问题:
(1)装置A中发生反应的化学方程式。
(2)装置B中所盛的试剂是。
(3)如果将制备氨气和氨气喷泉组合为一整套实验,用字母表示接口的连接顺序:
()、()、C、()()()()()
(4)组装好装置,检查装置的气密性后,加入试剂关闭K3,打开K1、K2给A装置试管进行加热。当(填写现象)时,即烧瓶中氨气收满。
(5)装置E的作用。
(6)请叙述引发该喷泉实验的操作过程。
某班学生在老师指导下探究氮的化合物的某些性质。
(1)同学甲在实验室利用下列装置(后面有图)制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:
①仪器B的名称:__________。B内只需加 入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原
入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原 因(结合化学方程式回答)___。
因(结合化学方程式回答)___。
②按气流方向连接各仪器(填接口字母)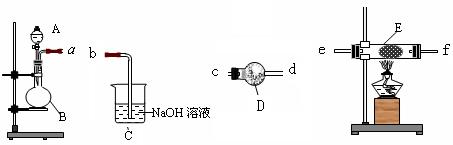
(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下: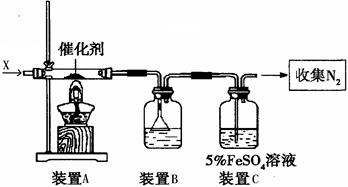
①装置C的作用可能是 ____________。
②若进入装置A的NO共268.8mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为。
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
计算在t=500s时,NO2的反应速率为。
可用图示装置制取少量乙酸乙酯。已知乙酸乙酯的沸点低于乙醇。请填空: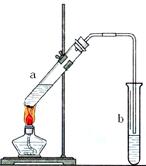
(1)试管a中需加入 浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是。
浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是。
(2)为防止a中的液体在实验时 发生暴沸,在加热前应采取的措施是。[
发生暴沸,在加热前应采取的措施是。[
(3)实验中加热试管a的目的是:
①;
②。
(4)试管b中加有饱和Na2CO3溶液,其作用是。
(5)试管b中导气管不伸入液面下的原因是。
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备、夹持固定装置和连接用橡胶管均略去),甲、乙两位同学分别进行了如下实验。请根据要求回答下列问题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。 (1)甲同学在气体入口处通入CO和CO2的混合气体,E内放置CuO,并选择其他合适装置获得了纯净干燥的CO,验证了CO的还原性及氧化产物。该同学所选装置的连接顺序为A→() → () →() → () →()(填代号、下同)。能验证CO氧化产物的现象是。
(1)甲同学在气体入口处通入CO和CO2的混合气体,E内放置CuO,并选择其他合适装置获得了纯净干燥的CO,验证了CO的还原性及氧化产物。该同学所选装置的连接顺序为A→() → () →() → () →()(填代号、下同)。能验证CO氧化产物的现象是。
(2)甲同学完成实验后,乙同学认为在甲同学实验基础上稍加改装就可制取纯净干燥的O2,并用O2氧化乙醇。
①乙同学首先将装置E内CuO换为Na2O2;
②然后按A→ ()→ ()→ () →()的顺序组合装置,保持活塞a关闭,打开活塞b。开始反应一段时间后E中反应方程式为:;
(3)乙同学实验后认为装置H在设计上有明显缺陷,并提出了如右图所示的替代方案,则试管n中应装入的试剂为(填化学式),其作用是。