[化学——选修3:物质结构与性质]
已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性。
(1)E基态原子的核外电子轨道式为____________________________________________。第二周期基态原子未成对电子数与F相同且电负性最小的元素名称为_______________。
(2)CD3-的空间构型为_______________________。
(3)A、B、D三元素组成的一种化合物X是家庭装修材料中常含有的一种有害气体,X分子中的中心原子采用_____________杂化。
(4)F(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。根据等电子原理,B、D 分子内σ键与π键的个数之比为______________。
(5)一种EF的合金晶体具有面心立方最密堆积的结构。在晶胞中,F位于顶点,E位于面心,该合金中EF的原子个数之比为_________________。若晶胞边长a pm,则合金密度为______________g·cm3(列式表达,不计算)。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知: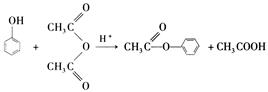
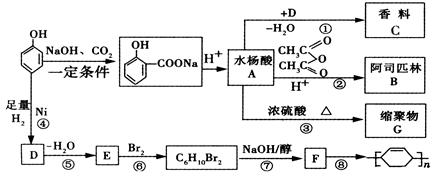
(1)写出C的结构简式。
(2)写出反应②的化学方程式。
(3)写出G的结构简式。
(4)写出反应⑧的化学方程式。
(5)写出反应类型:④,⑦。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是。
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液
按要求书写下列化学方程式:
(1)制取TNT炸药:
(2)苯甲醛的银镜反应:
(3)合成酚醛树脂:
(10分) 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g)△H<0
CO2(g)+H2(g)△H<0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=.
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将,该反应的化学反应速率将(均填“增大”“减小”或“不变”)。
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.
Cr2O72-+H2O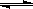 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈色,因为。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈色,
因为。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡,溶液颜色将。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。