氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
| A.这“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH + 3H+ + NO3—= Cu2++ NO↑+ 2H2O |
| D.CuH在氯气中燃烧:CuH + Cl2=" CuCl" + HCl |
已知:P4(g)+6Cl2(g  4PCl3(g)ΔH=
4PCl3(g)ΔH=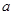 kJ·mol-1,P4(g)+10Cl2(g)
kJ·mol-1,P4(g)+10Cl2(g) 4PCl5(g) ΔH="b" kJ·mol-1,P4具有正四面体结构,PCl5中P-C1键的键能为c kJ·mol-1,PCl3中P-C1键的键能为1.2c kJ·mol-1。
4PCl5(g) ΔH="b" kJ·mol-1,P4具有正四面体结构,PCl5中P-C1键的键能为c kJ·mol-1,PCl3中P-C1键的键能为1.2c kJ·mol-1。
下列叙述正确的是
| A.P-P键的键能大于P-C1键的键能 |
B.可求Cl2(g)+PCl3(g) PCl5(s)的反应热ΔH PCl5(s)的反应热ΔH |
C.C1-C1键的键能为(b-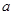 +5.6c)/4kJ·mol-1 +5.6c)/4kJ·mol-1 |
D.P-P键的键能为(5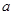 -3b+12c)/8kJ·mol-1 -3b+12c)/8kJ·mol-1 |
①C(s)+O2(g) CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g) 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
| A.1︰1 | B.1︰2 | C.2︰3 | D.3︰2 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
| A.CO2(g) + 2NH3(g)=CO(NH2)2(s) + H2O(g) ΔH<0 |
| B.CO2(g) + H2(g)=CO(g) + H2O(g) ΔH>0 |
| C.CH3CH2OH(g)=CH2=CH2(g) + H2O(g) ΔH>0 |
| D.2C6H5CH2CH3(g) + O2(g)=2C6H5CH=CH2(g) + 2H2O(g)ΔH<0 |
1 molCH4气体完全燃烧放出的热量为802kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519kJ。如果1 molCH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25kJ的热量,则一定量O2的质量为
| A.40g | B.56g | C.60g | D.无法计算 |
已知化学方程式:2SO2(g)+O2(g)=2SO3(g) ΔH=-QkJ·mol-1(Q>0)。下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1mol O2(g)所具有的总能量低于2molSO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2mol SO2(g)被氧化 |