下列说法正确的是( )
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-)>c(NH4+) |
| C.0.1 mol/L的氯化铵溶液与0.05 mol/L的氢氧化钠溶液等体积混合,溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-) |
| D.0.1 mol·L-1硫化钠溶液中离子浓度关系c(OH-)=c(H+)+c(HS-)+c(H2S) |
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供腺务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图。下列有关叙述正确的是
A.H +从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l) + H2O(l)-6e-=CO2(g) + 6H +
C.d导出的是CO2
D.图中b、c分别是O2、甲醇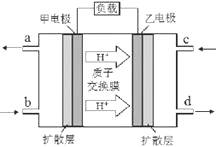
NaBH4/H2O2燃料电池(DBFC)的结构如下图,有关该电池的说法正确的是
A.电极B是燃料电池的负极
B.电池的电极A反应为:BH4-+8OH--8e-===BO2-+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个
对于反应2SO2(g)+O2(g) 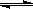 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
下列热化学方程式或离子方程式中,正确的是:
| A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O |