现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
已知化学反应N2+3H2====2NH3的能量变化如图所示。
(1)1 mol N 和3 mol H 生成1 mol NH3(g)是_________________能量的过程(填“吸收”或“释放”)。
(2)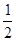 N2(g)+
N2(g)+ H2(g)====NH3(g) ΔH=_________________。
H2(g)====NH3(g) ΔH=_________________。
(3)N2(g)和H2(g)生成NH3(l)的热化学方程式____________________。
由化学能产生的能量是目前人类使用的主要能源。请回答下列问题:
(1)N2和O2在一定条件下反应生成NO2的热化学方程式为: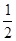 N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
(2)化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 |
键能( kJ·mol-1) |
化学键 |
键能( kJ·mol-1) |
| N≡N |
942 |
H—O |
460 |
| N—H |
391 |
O==O |
499 |
| H—H |
437 |
①写出N2和H2反应合成氨的热化学方程式_________________________。
②已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。计算1 g H2完全燃烧时放出的热量___________________。H2O(g)的稳定性___________(“大于”“小于”)H2O(l)。
(3)写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式_________________________________________________________________________。
在某一容积为5 L的密闭容器内,加入0.2 mol CO和0.2 mol H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图所示:
(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为__________,反应达平衡时,c(H2)=__________。
(2)判断该反应达平衡的依据是__________(填序号)。
①CO减少的速率和CO2减少的速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④该条件下正、逆反应速率都为零
(3)如果一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同条件下,反应达平衡时,c(H2O)=__________。
煤燃烧的反应热可通过以下两个途径来利用:A.利用煤在充足的空气中直接燃烧产生的反应热;B.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)====CO2(g) ΔH=E1①
b.C(s)+H2O(g)====H2(g)+CO(g) ΔH=E2②
H2(g)+1/2O2(g)====H2O(g) ΔH=E3③
CO(g)+1/2O2(g)====CO2(g) ΔH=E4④
完成下列问题:
(1)与途径a相比途径b有较多的优点,即_________________________。
(2)上述四个热化学方程式中的哪个反应的ΔH>0?___________________。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用总能量关系正确的是________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为_________________________。
近20年来,对于氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、太阳能等的能量来制取的所谓的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_______________。
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.以石油、天然气为原料 |
(2)氢气燃烧时耗氧量小,发热量大。已知碳和氢气燃烧的热化学方程式为:
C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_______________。
(3)氢能源有可能实现能源的贮存,也可能实现经济、高效的输送。研究表明过渡金属的氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间时,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、Ce H2.69。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_________________。