下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ |
C.Cl2+ 2NaOH NaClO+NaCl+H2O NaClO+NaCl+H2O |
| D.NH4Cl+NaOH= NaCl+NH3↑+H2O |
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:

| A.在A点:c(Na+)> c(OH—)> c(CH3COO—)> c(H+) |
| B.在A点:c(Na+)+ c(H+)==c(OH—)+c(CH3COO—) |
| C.在B点:c(CH3COO—)> c(Na+)> c(H+)= c(OH—) |
| D.在C点:c(CH3COO—)> c(Na+)> c(H+)> c(OH—) |

| A.两装置中锌片都发生氧化反应 |
| B.两装置中溶液的pH均增大 |
| C.两装置中铜片的质量均逐渐减小 |
| D.两装置中铜片表面均无气泡产生 |


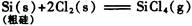

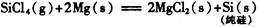
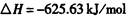
生产1.00kg纯硅的总反应热为:()
| A.2.43 × 104 kJ | B.—2.35 × 104 kJ |
| C.—2.23 × 104 kJ | D.—2.14× 104 kJ |
 2Z
2Z
| A.平衡常数K值越大,X的转化率越大 |
| B.达到平衡时,反应速率v正(X)==2v逆(Y) |
| C.达到平衡后,降低温度,正向反应速率减小的倍数小于逆向反应速率减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方法移动 |