(1)32Ge原子核外电子有 种不同的运动状态,原子核外电子排布式为 。
(2)写出氮原子的核外电子的轨道表示式 。
(3)写出CCl4的电子式 ,其中心原子的杂化方式 。
(Ⅰ)某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号)________。
a.C7H12O2b.C6H14c.C6H14Od.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。A的结构简式为________________;
(3)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为______________。
(Ⅱ)1mol分子式为CmHn的有机物在氧气中完全燃烧,生成CO2和H2O的物质的量相等,并消耗168L氧气(标况下)。该有机化合物的分子式____ _____;
(Ⅲ)某有机物A是烃的含氧衍生物,为测定其组成有如下实验结果:
①在一定温度和压强下将A汽化,其质量是同温、同压下氢气质量的76倍;
②称取7.6g有机物A,在过量氧气中完全燃烧。将反应后的混合气体通过足量浓H2SO4后体积变为10.64L,浓硫酸增重3.6g。再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定)。确定A的分子式。
德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:
①按下图所示的装置图连接好各仪器;②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。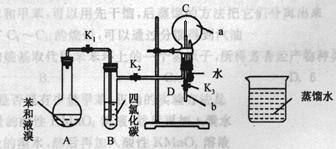
试回答:
(1)A中所发生的反应的反应类型为,能证明凯库勒观点错误的实验现象是;
(2)装置B的作用是 ;
(3) 写出A中发生反应的化学方程式;
(4)实验前应对A、B、C三个装置的气密性进行检查,则检查装置C的气密性的操作为
。
在某化学反应中,反应混合物A、B、C的物质的量浓度(mol·L—1)与时间t(s)关系如表所示。
| t(s) |
200 |
400 |
800 |
| c(A)(mol·L—1) |
1.45 |
1.28 |
1.00 |
| c(B)(mol·L—1) |
0.38 |
0.72 |
1.28 |
| c(C)(mol·L—1) |
0.095 |
0.18 |
0.32 |
(1)该反应的化学方程式为。
(2)用A浓度变化表示200~800 s内反应的平均反应速率为mol/(L·min)。
(3)用C浓度变化表示400~800 s内反应的平均反应速率为 mol/(L·s)。
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,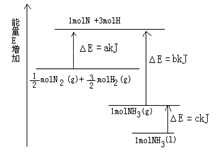
(1)1mol N 和3mol H 生成1mol NH3(g)是能量的过程(填“吸收”或“释放”)。
(2)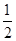 N2(g)+
N2(g)+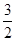 H2(g)
H2(g)  NH3(g )△H=;
NH3(g )△H=;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________
________________________________________________________________________。
(2)要加快上述实验中气体产生的速率,还可采取的措施有______________________
__________________________________________________________________(答两种)。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
其中:V1=,V6 ,V9=。