将下列物质按照要求由高到低的顺序排列
(1)NaF、NaCl、冰醋酸、SiC四种物质的熔沸点顺序: 。
(2)C、N、O三种元素的第一电离能: 。
(3)H2O的相对分子质量比H2S小,但沸点却高的原因 。
(4)某气态团簇分子的分子结构如图所示,其晶体的晶胞与CO2晶体的晶胞类型相同,则该团簇分子的分子式为 。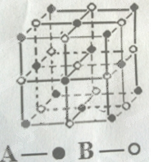
原电池是化学对人类的一个重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是__________,
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:____________________,Cu片上发生的电极反应:____________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻__________。
下表为元素周期表的一部分,请回答有关问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)⑤和⑦的元素符号是__________和__________;
(2)表中最活泼的金属是__________,非金属最强的元素是__________(填写元素符号);
(3)表中能形成两性氢氧化物的元素是__________,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:
__________________________________________________,
__________________________________________________,
(4)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:_____________________。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是_______。
①C(CH3)4和C4H10
② 和
和
③35Cl和37Cl
④ H2O和
H2O和 H2O
H2O
⑤石墨和金刚石
⑥ 和
和
⑦(CH3)2CHCH(CH3)2和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称________________;
(2)A、B形成的化合物的电子式___________________________;
(3)C的元素符号________,C的最高价氧化物的化学式_________________________;
(4)B的最高价氧化物对应水化物的浓溶液与单质Cu反应的化学方程式为____________