某酯K是一种具有特殊香气的食用香料,广泛应用于食品和医疗中。其合成路线如下:
已知: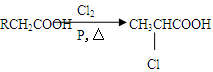
(1)E的含氧官能团名称是 。
(2)试剂X是 (填化学式);②的反应类型是 。
(3)D的电离方程式是 。
(4)F的分子式为C6H6O,其结构简式是 。
(5)W的相对分子质量为58,1 mol W完全燃烧可产生3.0 mol CO2和3.0 mol H2O,且
W的分子中不含甲基,为链状结构。⑤的化学方程式是 。
(6)G有多种属于酯的同分异构体,请写出同时满足下列条件的所有同分异构体的结构简式: 。
① 能发生银镜反应且能与饱和溴水反应生成白色沉淀
② 苯环上只有两个取代基且苯环上的一硝基取代物只有两种
(1)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为:
SiO2+2C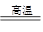 Si+2CO↑,在该反应中氧化剂是_____________________________,被氧化
Si+2CO↑,在该反应中氧化剂是_____________________________,被氧化
的物质与被还原的物质的物质的量之比是____________________________。
(2)请写出铜和稀硝酸反应的化学方程式:,若制得标准状况下的气体 4.48L,则参加反应的硝酸的物质的量为________ mol,转移电子的物质的量为________mol.
下图所示各物质是由短周期部分元素组成的单质或化合物,图中部分反应条件及物质未列出。已知:A、C、D、F、K均为单质;C、E、F、G、K常温下是气体且K为黄绿色气体;J为白色沉淀且既能溶于B的水溶液,又能溶于E的水溶液;B、G可以使湿润的红色石蕊试纸变蓝;反应④是化肥制造业的重要反应。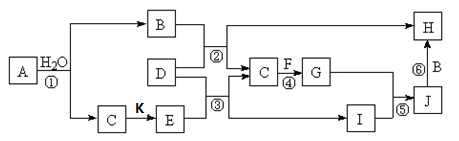
请回答下列问题:
(1)G的电子式为_______________。
(2)J的化学式为_______________。
(3)写出反应②的离子方程式:______________。
(4)写出反应④的化学方程式:______________。
《有机化学基础》
(1)有机物含有的官能团不同,性质也有差异。
①1mol下列有机物可与2mol溴单质发生加成反应的是(填字母)。
A.乙烯 B.乙炔 C.乙烷
②下列有机物中,核磁共振氢谱只有一个吸收峰的是(填字母)。
A.苯 B.苯酚 C.苯甲酸
③下列有机物中,能发生银镜反应的是(填字母)。
A.乙酸乙酯 B.乙醇 C.葡萄糖
(2)分子式为C4H10O,属于醇的同分异构体有种,其中一种不能氧化成醛或酮,它的结构简式是;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式。
(3)科学家常采用将药物连接在高分子载体上,制成缓释长效药物。已知某种解热镇痛类药物,其结构简式为A,把它连接到高分子聚合物B上,形成缓释长效药物C。

A C
分子聚合物B的结构简式为。
A与B反应生成C的有机反应类型是。
③A可水解成和(写结构简式)。
《化学与生活》
(1)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是(填字母)。
A.加钙盐 B.加碘盐 C.加锌盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。在化学分类中,纤维素属于(填字母)。
A.蛋白质 B.脂肪 C.多糖
③某同学感冒发烧,他可服用下列哪种药品进行治疗(填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
① 在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点。(选填“高”或“低”)
② 炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是由腐蚀造成的。
③ 石英玻璃纤维又称光导纤维,其主要成分和NaOH溶液反应的离子方程式为
。有机玻璃受热时会软化,易于加工成型。有机玻璃是一种材料(选填“橡胶”或“纤维”或“塑料”)。
(3)防治环境污染,改善生态环境已成为全球的共识。
① pH<5.6的雨水称为酸雨,主要是由人为排放的硫氧化物和等酸性气体转化而成的。向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2。发生反应的化学方程式为。
②NaNO2作为食品添加剂不能大量食用,因为它会与肉类中的蛋白质反应生成致癌的化合物。CO使人中毒是因为很容易和人体血液中的结合。
③城市餐饮业会产生大量污染环境的“地沟油”。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和。生活中会产生大量废弃塑料,将废弃塑料进行处理,可以获得乙烯、丙烯等化工原料。
已知氧化性Fe3+>Cu2+>Fe2+。现有一包铁粉和铜粉混合粉末,某研究小组同学为了确定其组成,利用1.2mol/L的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
| 组别 |
||||
| V[FeCl3(aq)]/mL |
50 |
50 |
50 |
50 |
| 混合粉末质量/g |
1.2 |
2.4 |
3.6. |
4.8 |
| 反应后剩余固体质量/g |
0 |
0.64 |
1.92 |
3.12 |
分析表中数据,下列结论正确的是
A.第①组反应后溶液中剩余c(Fe3+)=0.4mol/L B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0mol/LD.原混合粉末中n(Fe)∶n(Cu)=1∶2