铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Al(OH)3 |
Cr(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
1.5 |
3.4 |
4.9 |
6.3 |
9.6 |
| 完全沉淀 |
2.8 |
4.7 |
5.5 |
8.3 |
12.4 |
根据表中数据,流程中的a为 。
(5)分离滤渣2中物质,发生反应的离子方程式是 。
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有(填序号)
A:σ键
B:π键
C:氢键
D:配位键
E:分子间作用力
F:金属键
G:离子键
(2)下面关于晶体的说法不正确的是___________
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF>NaCl>NaBr>NaI |
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
①图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为,图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为;
②H3BO3晶体中B原子杂化方式______;
③三种晶体中熔点高低的顺序为(填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为_______________。
(4)碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_____cm(用代数式表示)。
(选考)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n |
Ksp |
pH |
|
| 开始沉淀 |
沉淀完全 |
||
| Al(OH)3 |
1.9×10-33 |
3.43 |
4.19 |
| Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
| Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ和沉淀Ⅲ(填化学式),则pH1pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用。.
A.pH试纸B.石蕊指示剂C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则反应③的化学方程式是。第③步反应后,过滤沉淀时需要的玻璃仪器有.若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式_____________________________________________。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K=。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正V逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g)= H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:。
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
(1)元素C的最高价氧化物的电子式为;元素G的离子结构示意图为。
(2)元素L位于周期表的第族,1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题(答题时A、B、C、D、E用所对应的元素符号表示)
| A |
A的一种单质在自然界中硬度最大 |
| B |
B元素的第一电离能比同周期相邻两个元素都大在同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| C |
D的基态原子M层电子数是K层的2 倍 |
| D |
E与C位于不同周期,E原子核外最外层电子数与C相同其余各层电子均充满 |
(1)E在周期表中位于第_______周期第 ________族,C基态原子核外电子排布式是_______。
(2)A、B、D三种元素电负性由大到小排列顺序为________,其中A的最高价氯化物为_______(填“极性分子”或“非极性分子”)。
(3)A和B的最简单氢化物中沸点较高的______。原因是__________。
(4)已知:①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g)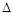 H1=" -867" kJ·mol-1
H1=" -867" kJ·mol-1
②2BO2(g)-B2 O4(g)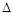 H2="-56.9" kJ·mol-1写出AH4和B2O4反应的热化学方程式。
H2="-56.9" kJ·mol-1写出AH4和B2O4反应的热化学方程式。