不能用于判断HA是弱电解质(弱酸)的依据是( )
A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为
| A.2︰3 | B.3︰1 | C.2︰1 | D.1︰2 |
如下图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始时V(A)="V(B)=a" L。在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2Z(g)+W(g);△H>0,达到平衡时,V(A)="1.1a" L。下列说法不正确的是
2Z(g)+W(g);△H>0,达到平衡时,V(A)="1.1a" L。下列说法不正确的是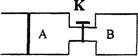
A.反应开始时,B容器中化学反应速率比A容器中快
B.A容器中X的转化率为20%,且比B容器中X的转化率小
C.打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计)
D.打开K达新平衡时,升高B容器的温度,A容器的体积会增大
已知4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H=﹣xkJ/mol。蒸发1mol H2O(l)需要吸收的能量为44kJ,其它相关数据如下表:
| NH3(g) |
O2(g) |
NO(g) |
H2O(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
a |
b |
z |
d |
则表中z(用x、a、b、d表示)的大小为
A.(x+4a+5b﹣44)/4B.(x+12a+5b﹣12d﹣264)/4
C.(x+4a+5b﹣6d﹣264)/4 D.(x+12a+5b﹣12d﹣44)/4
E和F加入密闭容器中,在一定条件下发生反应: E(s)+4F(g) G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
| 温度℃ |
25 |
80 |
230 |
| 平衡常数值 |
5×104 |
2 |
1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g) E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正) >v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
某同学按下图所示的装置进行试验。A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处SO42﹣从右向左移动。下列分析错误的是
A.金属活动性A强于B
B.B的电极反应:B﹣2e-=B2+
C.X电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色沉淀,不久沉淀溶解