2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾履形成的原因。
(1)汽车尾气净化的主要原理为;2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____。
| A.在单位时问内生成1mol CO2的同时消耗了lmol CO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线: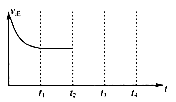
③若要同时提高该反应的速率和NO的转化率,采取的措施有_____、____。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应原理为C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应在___下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为____。(已知:H2S: Ka1=9.1×10-8;Ka2=1.1×10-12。H2CO3:Ka1=4.30×10-7;Ka2=5.61×10-11)
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验 |
温度/℃ |
起始量/mol |
平衡量/mol |
达平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1条件下平衡常数K=______(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ______0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时υ正______υ逆(填“<”,“>”,“=”)。
已知烃基烯基醚水解反应:R-CH=CH-O-R′ 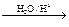 R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题:
R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题: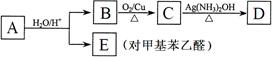
⑴ A的结构简式为________________________,B的名称是___________________。
⑵写出B → C反应的化学方程式:________________ _______________________。
_______________________。
⑶写出两种符合下列条件的E的同分异构体的结构简式:__ ___________________。
___________________。
① 属于芳香醛; ② 苯环上有两种不同的氢原子。
⑷由E转化为对甲基苯乙炔(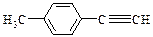 )的一条路线如下:
)的一条路线如下: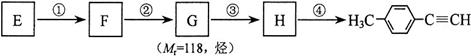
(I)写出G的结构简式:_____________________________。
(II)步骤②所加试剂及反应条件为:____________。步骤④的反应类型为:________。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)+ 49kJ
CH3OH(g)+H2O(g)+ 49kJ
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。a,b,c,d括号内数据表示坐标。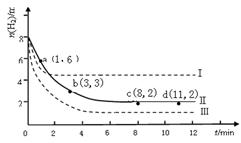
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线III对应的实验条件改变是_________。
(4)比较以上三种不同状态下的平衡常数大小(用KⅠ、KⅡ、KⅢ表示)。
(5)若在开始时,科学实验将3molCO2和4molH2充入2L的密闭容器中,其他条件不变,达平衡后氢气的物质的量n1mol(填大于,小于或等于)。
已知:还原性HSO3->I-,氧化性IO3-> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目。
囗NaIO3+囗NaHSO3 → 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后 溶液中的还原产物为_________(填化学式);
溶液中的还原产物为_________(填化学式);
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的 量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式__________________________;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为mol。
量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式__________________________;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为mol。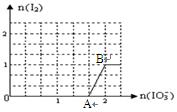
根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且离子半径最小的元素位于周期表的第________________族。其氧化物属于________晶体。
(2)金属钠在一定条件下与氢气反应生成氢化钠(2Na+H2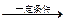 2NaH)。生成物氢化
2NaH)。生成物氢化
钠的电子式为_________,含有的化学键为_______键(填“离 子”、“共价”或“金属”)。
子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.碱性:NaOH>Mg(OH)2>Al(OH)3b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示: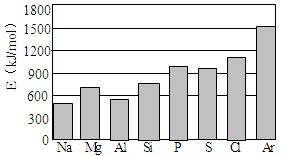
① 同周期内,随着原子序数的增大,E值变化的总趋势是________________。
② 根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。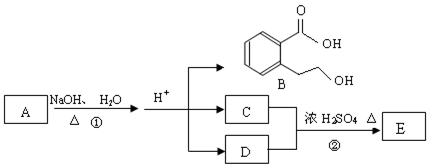
根据上图回答问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为; C分子中的官能团名称是 ______________;化合物B不能发生的反应是(填字母序号):
a.加成反应 b.取代反应 c.消去反应 d.酯化反应 e.水解反应 f. 置换反应
(2)反应②的化学方程式是__________________。
(3)反应②实验中加热的目的是:
Ⅰ。;
Ⅱ。。
(4)A的结构简式是 ________ __________。
__________。
(5)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构 Ⅱ.属于非芳香酸酯 Ⅲ.与 FeCl3溶液发生显 色反应。写出其中任意一个同分异构体的结构简式。
色反应。写出其中任意一个同分异构体的结构简式。