有五种摩尔质量均为44g/mol的化合物甲、乙、丙、丁、戊,均由短周期元素组成。对甲的捕获在降低温室气体排放中具有重要的作用。乙为烃,等物质的量的乙与丁充分燃烧产物为甲与水,且生成水的质量前者是后者的2倍,丙在一定条件下分解获得两种单质,两单质放电时反应生成A,A遇空气变成红棕色气体B。戊是一种极不稳定的物质,在1180℃以下不存在。科学家用质谱仪在工业制硅的反应产物中证实了其存在。
(1)丁的分子式 ,甲的电子式 。
(2)若生成戊的反应中氧化产物与还原产物为同一物质,写出生成戊的化学方程式 。
(3)把铁和铜混和物放入一定量B通入水后形成的稀溶液中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的溶质是 。
(4)将0.2mol乙完全燃烧后生成的气体全部缓慢通入300mL某浓度的NaOH溶液中,气体完全被吸收,溶液中NaOH无剩余,则NaOH溶液的浓度为 (若有定值则写具体数值,无定值则写范围)。
(5)将等物质的量A、B的混合物溶于NaOH溶液中得到只含有一种溶质的溶液,此溶质的化学式为 ,设计简单实验方案证明溶液中含有此溶质 。
在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入适量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为正四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式________________________________,四碘化二磷的磷的化合价为________,磷酸中磷的化合价为____________________,A中磷的化合价为____________________。
由短周期元素组成的A、B两种盐可发生变化,且B的焰色反应呈黄色(图中其他生成物未列出)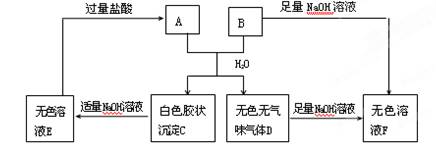
(1)无色溶液F中,一定含有的溶质的化学式为。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________________。
(3)A和B的混合物溶于水发生反应的离子方程式____________________________。
(4)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的 离子方程式_________________________________________________________。
离子方程式_________________________________________________________。
(16分)(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):
;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性 ,原因是(用离子方程式表示):__________________
_ _________________________________________________ 。
_________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
. 用双线桥法表示下列化学反应中的电子转移情况,是离子反应的将其改写为离子方程式,不是离子反应的可不填.
(1) 加热硝酸铵
5NH4NO3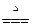 4N2↑+2HNO3+9H2O
4N2↑+2HNO3+9H2O
(2)在含有Na2S和Na2SO3的溶液中,加入稀硫酸
2Na2S+Na2SO3+3H2SO4==3Na2SO4+3S↓+3H2O
(3)铜片与稀硝酸反应
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO+4H2O
(12分)氯化钠溶液在生产、生活中都有广泛的用途。现配置1 L 0.2 mol·L-1 NaCl溶液。请回答问题。
| 实验步骤 |
有关问题 |
| (1)计算并称量 |
需要NaCl的质量为________g |
| (2)溶解 |
为加速溶解,可进行的操作是________ |
(3)转移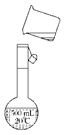 |
a. 指出示意图中的两处错误:错误1: _____________________ ________________________ ________________________ ____ ____错误2:___________________________________________ b. 若容量瓶不干燥,含有少量蒸馏水,会造成所配溶液的物质的量浓度 (填“偏高”“偏低”或“无影响”) |
| (4)定容 |
若仰视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度________(填“偏高”“偏低”或“无影响”) |