还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: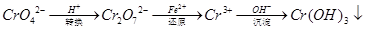
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
在恒温恒容条件下,能使A(g) + 2B(g)  C(g) +D (g) 正反应速率增大的措施是
C(g) +D (g) 正反应速率增大的措施是
| A.增大A的浓度 | B.减小C的浓度 |
| C.减小B的浓度 | D.减小压强 |
84消毒液的pH为10.2,可采用的适宜测定方法是 ()
| A.使用广泛pH试纸 | B.使用精密pH试纸 |
| C.使用pH计 | D.以酚酞为指示剂进行酸碱中和滴定 |
某温度下在密闭容器中发生反应2M(g)+N(g) 2E(g),若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了10%;若开始只充入2mol M和1mol N混合气体,达平衡时M的转化率为
2E(g),若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了10%;若开始只充入2mol M和1mol N混合气体,达平衡时M的转化率为
| A.20% | B.60% | C.80% | D.90% |
下列有关化学实验叙述正确的是()
| A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水 |
| B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶 |
| C.在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中 |
| D.若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液 |
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)  Z(g)+W(s) ΔH>0。下列叙述中,正确的是:
Z(g)+W(s) ΔH>0。下列叙述中,正确的是:
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡 |
| C.升高温度,平衡逆向移动 |
| D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |