(15分)过二硫酸钾(K2S2O8)是一种无色结晶,易溶于水,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4溶液得到。
实验步骤如下:
步骤1.称取KHSO4溶解蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
步骤2. 电解2h,每隔约半小时补一次冰
步骤3.过滤
步骤4.
步骤5.干燥、称重
(1)电解时溶液温度控制在5℃以下的原因是 。
(2)电解时阳极反应式为 。电解过程中, 阳极产生微量且能使湿润的KI-淀粉变蓝的单质气体,该气体可能是 (填化学式)。
(3)步骤4操作是 。
(4)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。
(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为 (用含c、V的代数式表示)。
(5)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
【改编】(12分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下: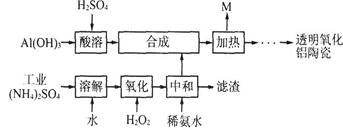
回答下列问题:
(1)酸溶时为了使氢氧化铝充分反应可以采取的措施为 ;酸溶的离子方程式为 。
(2)氧化时发生的主要反应的离子方程式 ;滤渣的主要成分为 (填化学式)。
(3)在合成步骤中生成硫酸铝铵[NH4Al(SO4)2],加热时没有电子转移,则M含有的主要物质的化学式为 ,M可用水或硫酸吸收转化为 (填化学式)以实现循环利用。
化学兴趣小组的同学设计实验探究浓硫酸与木炭反应后产生气体的成分。
(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目:____________________。
【装置设计】组装如下的实验装置,然后进行实验探究。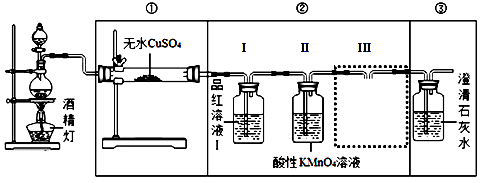
(2)装入反应物之前,必须先 。
(3)要验证产生的气体中含有CO2,请在答题卡中完成图中虚线框内的装置简图,并标明试剂。
【实验探究】
(4)观察实验,完成实验现象的部分记录:
| 实验装置 |
① |
② |
③ |
| 实验现象 |
…… |
(5)实验装置②中品红溶液Ⅰ的作用 ,III的作用 。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下: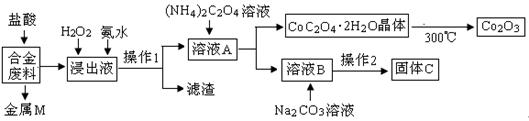
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。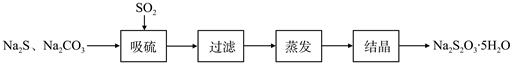
(1)吸硫装置如图所示。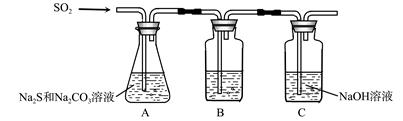
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 |
实验操作 |
预期现象 |
结论 |
| ① |
取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 |
_______________ |
样品含NaCl |
| ② |
另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 |
_______________ |
样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:IO3-+5I-+6H+==3I2+3H2O 2S2O32-+I2==S4O62-+2I-
下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。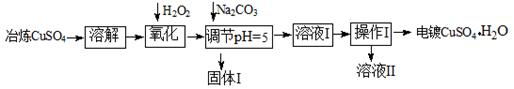
已知:①Fe3+ Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为① 。
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为______________。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式 。