【化学工艺与技术】 电镀污泥是指电镀废水处理后产生的污泥和镀槽淤泥,被列入国家危险废物名录,属于第十七类危险废物。 处置电镀污泥回收有价金属,既可以最低限度的降低环境污染,又可以最大限度地节约资源,可谓一举两得。电镀污泥中含有Cr(OH)3、Al(OH)3、Zn(OH)2、CuO、NiO等物质,工业上通过“中温焙烧-钠氧化法”回收Na2Cr2O7等物质。

已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②除去滤渣2后,溶液中存在如下反应:2 + 2H+
+ 2H+
 + H2O
+ H2O
③不同钠盐在不同温度下的溶解度如下表:
| 温度 化学式 |
20℃ |
60℃ |
100℃ |
| Na2SO4 |
19.5 |
45.3 |
42.5 |
| Na2Cr2O7 |
183 |
269 |
415 |
| Na2CrO4 |
84 |
115 |
126 |
(1)完成氧化焙烧过程中生成K2CrO4的化学方程式。
 Cr(OH)3+ Na2CO3+ Na2CrO4+ CO2 + ________
Cr(OH)3+ Na2CO3+ Na2CrO4+ CO2 + ________
(2)水浸后的溶液呈 (填“酸”、“碱”、“中”)性,该步骤过滤,在滤渣1中可进一步回收到重金属 。
(3)滤渣2的主要成分有Zn(OH)2、
(4)系列操作中继续加入H2SO4,加热蒸发,冷却结晶,过滤;继续加入H2SO4目的是______,可得到滤渣3的主要成分为 。
(5)工业上还可以在水浸过滤后的Na2CrO4溶液中加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式:_______________________________。
(6分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,溶液分层,下层呈紫红色;
(3)另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述碱性溶液加热,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实判断:在该溶液中肯定存在的离子是,肯定不存在的离子是,不能确定是否存在的离子是。
( 10分)甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的棒;乙池中的棒。
②在乙池中阳极的电极反应式是。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。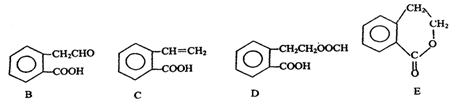
请回答下列问题:
(1)指出反应的类型:A→C:。
(2)在A~E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式
。
(13分) 通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
下面是9种化合物的转变关系:
(1)化合物①的结构简式,它跟氯气发生反应的条件A是。
(2)化合物⑤跟⑦可在酸的催化作用下去水生成化合物⑨,⑨的结构简式是,名称是。
(3)③→⑥的化学反应方程式是。
(4)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它,此反应的化学反应方程式是 _________________________________________。
请同学们根据官能团的不同对下列有机物进行分类。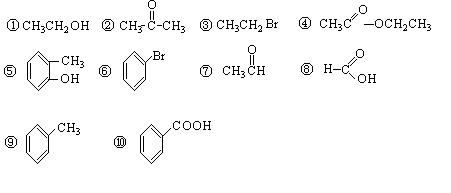
(1)芳香烃:;(2)卤代烃:(3)醇:;(4)酚:;(5)醛:;(6)酯:。