下列每组分别给出了两个量,其中可以求出物质的量的有( )。
| ① |
② |
③ |
④ |
⑤ |
| 物质所含的微粒数 |
固体体积 |
溶液的质量分数 |
标准状况下气体的摩尔体积 |
非标准状况下某物质的质量 |
| 阿伏加德罗常数 |
固体密度 |
溶液体积 |
标准状况下气体的体积 |
物质的摩尔质量 |
A.①②⑤ B.②③④ C.①④⑤ D.①③④
下列有关气体体积的叙述中,正确的是()
| A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子的大小决定 |
| B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定 |
| C.不同的气体若体积不同,则它们所含的分子数也不同 |
| D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L |
超导材料为具有零电阻及反磁性的物质,以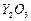 、
、 和CuO为原料、经研磨烧结可合成一种高温超导物
和CuO为原料、经研磨烧结可合成一种高温超导物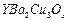 ,现欲合成0.5 mol此高温超导物,依化学剂量比例.需取
,现欲合成0.5 mol此高温超导物,依化学剂量比例.需取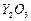 、
、 和CuO的物质的量分别为 ( )
和CuO的物质的量分别为 ( )
| A.0.50,0.50,0.50 | B.0.25,1.0,1.5 |
| C.0.50,1.0,1.5 | D.1.0,0.25,0.17 |
下列关于物质的量的叙述中,正确的是()
| A.1mol食盐含有6.02×1023个分子 | B.Mg的摩尔质量为24 |
| C.1mol水中含有2mol氢和1mol氧 | D.1molNe含有6.02×1024个电子 |
下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂 |
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质 |
C.实验室制备Cl2,可用排放和食盐水集气法收集 |
D.1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
用NA表示阿伏加德罗常数的值。下列叙述正确的是


A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |