取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 ,此反应属于 (填反应类型)。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生丁达尔效应。这个实验可以用来区别 。
(4)用Fe(OH)3胶体进行下列实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明 ,这种现象称为 。
②向其中加入饱和(NH4)2SO4溶液发生的现象是 ,原因是 。
③向其中滴入过量稀硫酸,现象是 ,其原因是 。
④提纯此分散系常用的方法是 。
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式
=,
0(填">"、"<"或"=");
(2)在一个容积为10
的密闭容器中,1000℃时加入
、
、
、
各1.0
,反应经过l0
后达到平衡。求该时间范围内反应的平均反应速率
=、
的平衡转化率=:
(3)欲提高(2)中
的平衡转化率,可采取的措施是。
A.减少 的量
B.增加 的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(I已知: ,如果要合成
,如果要合成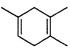 所用的原始原料可以是
所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D、2,3-二甲基-l,3-丁二烯和丙炔
II
都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0
化合物
完全燃烧生成8.8
和3.6
;
的蒸气与氢气的相对密度为30,则
的分子式为:
(2)
为一取代芳烃,
中含有一个甲基。由
生成
的化学方程式为;
(3)由
生成
、由
生成
的反应条件分别是、;
(4)由
生成
、由
生成
的反应类型分别是、;
(5) 存在于栀子香油中,其结构简式为;
存在于栀子香油中,其结构简式为;
(6)在
的同分异构体中,苯环上一硝化的产物只有一种的共有个,其中核磁共
振氢谱有两组峰,且峰面积比为l:1的是 (填结构简式)。
钒(
)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)
是接触法制硫酸的催化剂.
①一定条件下,
与空气反映t
后,
和
物质的量浓度分别为
和
, 则
起始物质的量浓度为mol/L ;生成
的化学反应速率为
.
②工业制硫酸,尾气
用吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由色变为色.
③放电过程中氢离子的作用是和;充电时若转移的电子数为3.01 1023个,左槽溶液中
的变化量为.
1023个,左槽溶液中
的变化量为.
阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到
和
两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备
①
可由人类重要的营养物质水解制得(填"糖类"、"油脂"或"蛋白质").
②
与新制的
反应生成
,其化学方程式为.
③
经加聚反应生成
,
的结构简式为.
(2)阻垢剂
的制备

①
为取代反应,
的结构简式为.
②
转化为
的过程中,
分子中增加的碳原子来源于.
③由
制备
的反应步骤依次为:
![]() 、、(用化学方程式表示).
、、(用化学方程式表示).
④1
的同分异构体
(碳链无支链)与足量
溶液作用产生2
,
的结构简式为(只写一种).
已知:
以乙炔为原料,通过下图所示步骤能合成有机中间体
(转化过程中的反应条件及部分产物已略去)。
其中,
、
、
、
分别代表一种有机物,
的化学式为
,分子中无甲基。
请回答下列问题:
(1)
生成
的化学反应类型是。
(2)写出生成
的化学反应方程式:。
(3)
在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比
小的有机产物的结构简式:。
(4)写出
生成
的化学反应方程式:。
(5)含有苯环,且与
互为同分异构体的酯有种,写出其中一种同分异构体的结构简式:。