高血脂症是现代人的健康杀手之一,科学家最新研制的一种可用于治疗高血脂的新药H可按如下路线合成。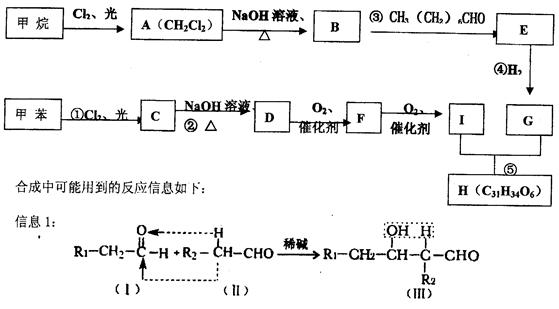
信息2:两个羟基同时连在同一个碳原子上的结构是不稳定的,会发生脱水反应: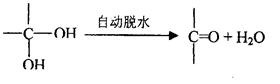
根据以上图示和信息,回答下列问题:
(1)反应①—⑤中属于取代反应有 (填写反应的编号),B中官能团的名称为
。
(2)完全燃烧时,1mol D与1mol下列 的耗氧量相同(填写字母的代号)。
a. C6H6 b. C7H8O3 c. C6H10O2 d. C7H8O
(3)G的分子式为C10H22O3,写出E、F结构简式:
E F
(4)写出与I互为同分异构体,且既含有苯环又能发生银镜反应的物质的结构简式
、 、 、
(5)写出F与新制氢氧化铜悬浊液反应的化学方程式:
(6)写出H与NaOH溶液共热的化学方程式
向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.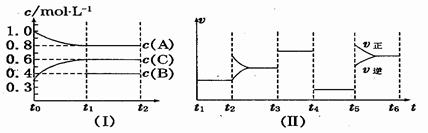
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为。
(2) t4~t5阶段改变的条件为,B的起始物质的量浓度为,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1=(保留两位小数),
K1、K2、K3、K4、K5之间的关系为(用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为.
现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:②④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH7 (填“>”“<”或“:”).,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
| A.c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—) |
B.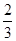 c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) |
| C.c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+) |
| D.c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+) |
pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加mL。
(2)如果加入pH=10的NaOH溶液,就加mL。
(3)如果加0.01mol/L的HC1,应加mL。
在一个固定体积的密闭容器中发生某反应,当改变其他反应条件,在I、II、III阶段,体系中各物质浓度随时间变化的曲线如下图所示: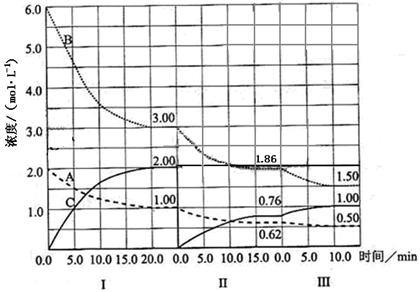
(1)该反应的化学方程式为(物质用图中的“A”、“B”、“C”表示),该反应在第I阶段的平衡常数为。
(2)第III阶段,从开始至平衡,用B表示的平均反应速率为;
(3)第I阶段,A的转化率为;第III阶段达平衡后,C的体积分数为;
(4)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(5)已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),则该反应的正反应
△H0(填“<”或“>”)
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g)△H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H =-566.0 kJ·mol-1
(1)试写出2molCH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在极反应;O2一极发生的电极反应方程式为
(3)若用该电池在某金属表面镀铜,若待镀金属的质量增加了6.4g,则至少消耗甲醇的质量为g。