高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。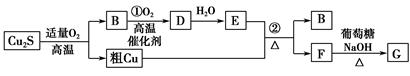
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
.实验室用需配制250mL0.1mol/L的Na2CO3溶液, 填空并请回答下列问题:
填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
实际应称Na2CO3质量 /g /g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ___ _____;
| A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
| B.用托盘天平准确量取所需的碳酸钠的质量,加水(约30mL)溶解 |
| C.将溶解液注入容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.逐滴加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作,若加蒸馏水时不慎超过了刻度,若定容时俯视刻度线___________________,称量时游码和物体位置放错,Na2CO3含有少量结晶水。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面。
氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的()中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第②步
第③步
第⑤步
下列五组物质,每组中有一种物质从某种角度分析与其它四种不同,请找出该物质,并说明理由。
⑴Fe、S、C、P不同物质 理由;
⑵H2、O2、N2、S 不同物质 理由;
⑶Fe2O3、NaCl、CuO、H2O不同物质 理由;
⑷AgCl、BaSO4、KNO3、CaCO3不同物质 理由;
⑸CuSO4、FeCl3、KMnO4、K2CO3不同物质 理由。
通过《化学与生活》模块的学习,请你从衣食住行各方面谈谈怎样才能使自己身心发展更健康更科学?
全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A、B、C三支试管中进行研究。
(1)请你帮助该学生完成下列实验设计的内容:
| 编号 |
操作方法 |
实验目的 |
| A |
探究铁在干燥空气中的生锈情况 |
|
| B |
放入铁钉,注入蒸馏水浸没铁钉并用植物油液封 |
|
| C |
探究铁在有空气和水时的生锈情况 |
(2)一周后,编号为________的试管中的铁钉最易生锈。证明铁生锈的条件是:。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在新疆吐鲁番比安装在昆明滇池海埂大坝(填“更易”或“更难”)生锈。