有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,
通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。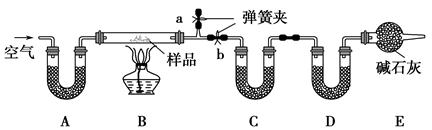
(1)加热前通入空气的目的是 ,
操作方法为 。
(2)装置A、C、D中盛放的试剂分别为:A ,
C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 。
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3的质量分数为 (用含w、m1、m2的代数式表示)。
(本题共14分)(每空2分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用( 选填序号)
a.KSCN溶液和氯水b.铁粉和KSCN溶液c.浓氨水 d.酸性KMnO4溶液
(3)分析上述(2)实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在 ,需在装置中添加M于(选填序号)。
,需在装置中添加M于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q气体,预计实验现象是。
(7)如果气体Y中含有H2气体,预计实验现象是。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: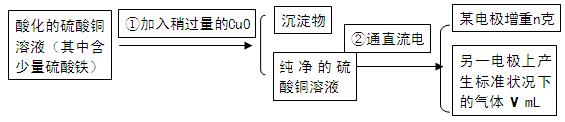
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如图所示,则A连直流电源的极(填“正”或“负”)。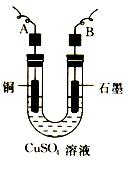
(3)电解开始后,在U形管中可以观察到的现象有:
电解的离子方程式(总反应)为
。
(4)下列实验操作中必要的是(填写字母)。
| A.称量电解前的电极的质量; |
| B.电解后,电极在烘干称量前,必须用蒸馏水冲洗; |
| C.刮下电解后电极上析出的铜,并清洗,称量; |
| D.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行; |
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。
(10分)工业合成氨气的 成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
(1) 下图装置中能用于实验室制NH3的是____________ .
.
(2) 写出用 NH4Cl和Ca(OH)2制取氨气的反应方
NH4Cl和Ca(OH)2制取氨气的反应方 程式:_______________.
程式:_______________.
(3) 将湿润的红色石蕊试纸伸入充满氨 气的试剂瓶中可以看到的现象是___________________.
气的试剂瓶中可以看到的现象是___________________.
(4) NH3在工业上除作为制作化肥的原料外,也常用来制取硝酸,其主要步骤为:
请 写出下列反应的化学方程式:
写出下列反应的化学方程式:
NH3→ NO : _________________________________________.
Cu和浓硝酸反应:_ __________________________________________.
__________________________________________.
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 _______________________.
(2)称取铁钉6.0g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除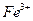 外还可能含有
外还可能含有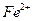 ;若要确认其中含有
;若要确认其中含有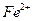 ,应首先用_________
,应首先用_________
进行检验(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.氨水 d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
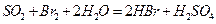 ;然后加入足量
;然后加入足量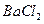 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中 的体积分数为 _____。
的体积分数为 _____。
[探究二]分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有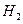 和Q气体。
和Q气体。 为此设计了下列探究实验状置(图中夹持仪器省略)。
为此设计了下列探究实验状置(图中夹持仪器省略)。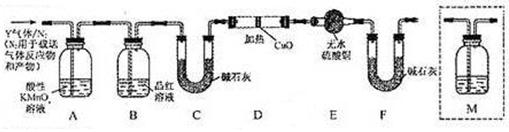
(3)装置B中试剂的作用是 __________________________;
(4)为确认Q的存在,需在装置中添加M于(选填序号)。
| A.A之前 | B.A-B间 | C.B-C间 | D.C-D间 |
(5)如果气体Y中含有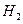 ,预计实验现象应是 ______________________
,预计实验现象应是 ______________________
____________________________
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。
a.KMnO4b.(NH4)2S c.H2O2 d.KSCN[
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为。加入CuO作用是 ____________________________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入)(填化学式)。
写出该反应的化学方程式 __________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液
应用______________(填写仪器名称);取A溶液稀释一定倍数后,用KM nO4标
nO4标
准溶液滴定,终点现象为。