MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: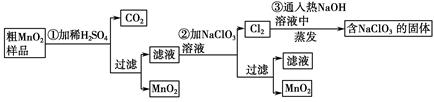
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。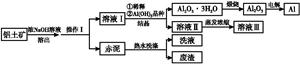
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有。
(2)为了提高铝土矿的溶出速率可采取的有效措施为(任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C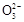 、HC
、HC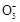 、Al
、Al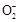 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是()
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是()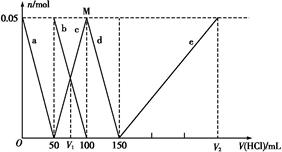
A.原混合溶液中的C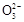 与Al 与Al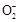 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.V1∶V2=1∶5 |
| C.M点时生成的CO2为0.05 mol |
D.a线表示的离子方程式为:Al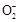 +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备
甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成C ,然后以C
,然后以C 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极电极反应式: 。
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行分析:
(1)该同学准备了下列实验用品:20% NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一个实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一
回答:
①若不是原电池,请说明原因: (如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是: 。
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:。
化合物C是一种合成药品的中间体,其合成路线为:

已知: 
(1)写出 中官能团的名称。
中官能团的名称。
(2)写出反应①的化学方程式。
(3)反应②属于反应(填有机反应类型)。
(4)D是比 多一个碳的同系物,则满足下列条件的D的同分异构体共有种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式。
多一个碳的同系物,则满足下列条件的D的同分异构体共有种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式。
①显弱碱性,易被氧化;②分子内含有苯环;③能发生水解反应
(5)请你设计由A合成B的合成路线。提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下: 。
。