在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
ΔH<0,其化学平衡常数K与温度T的关系如下表:
| T/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态的依据的是________(填字母编号)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数K的值为________,当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,该反应的v正(N2)________v逆(N2)(填“>”“<”或“=”)
N2(g)+3H2(g)的化学平衡常数K的值为________,当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,该反应的v正(N2)________v逆(N2)(填“>”“<”或“=”)
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①②。
(2)溶液中共有种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是:。
(4)向该溶液中加入AlCl3溶液,有白色胶状 沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式:。
沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式:。
Ⅱ、有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为(用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为(填序号),溶液②中c(Cl-)=。
日常生活中常见的金属材料有铝合金、钢铁等,某化学实验小组欲测定几种金属材料的耐腐蚀性,所用药品和试剂有:铝合金、钢铁、CO2、SO2、水。
(1)请完成以下实验设计表,并在实验目的的一栏中填入对应的实验编号:
| 实验编号 |
金属材料 |
溶液 |
实验目的 |
| ① |
铝合金 |
CO2+ H2O |
Ⅰ.探究不同溶液对金属材料的腐蚀速率; Ⅱ.探究不同金属材料的腐蚀速率; |
| ② |
|||
| ③ |
(2)在10%的盐酸中温度对铝合金的腐蚀速率影响关系见下图:铝合金在40℃时的腐蚀速率是20℃的倍.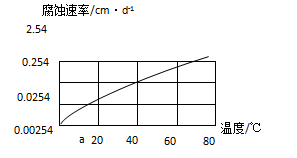
(3)请在上题图象中,画出铝合金在CO2溶液和SO2溶液中腐蚀速率随温度变化关系的预期结果示意图(都从a点开始)。
已知25℃、101kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。
(1)0.1mol甲烷和0.2mol氢气组成的混合气体在25℃、101kPa下完全燃烧释放的热量为;
(2)写出表示葡萄糖燃烧热的热化学方程式:;
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:
a极:,b极:;
若使用碱性电解质溶液,则b极的电极反应式为:b极:;
放电时电极a作极,外电路中电流从流向,电解质溶液中阳离子移向极;
(10分)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,既不能电离又不能水解的离子是,只能水解不能电离的离子是,只能电离不能水解的离子是,既能电离又能水解的离子是,能促进水电离的离子是,能抑制水的电离的离子是,写出阴离子水解的离子方程式。
有机物A的分子式为C3H4O2,下图是A~H 间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物。
已知:
①羟基与双键碳原子相连的醇不存在;
②同一个碳原子上连有两个或多个羟基的多元醇不存在。
请根据以上信息填空:
⑴指出下列反应的反应类型:A→C;E→G。
⑵写出A中含有官能团的结构简式:。
⑶写出C和F的结构简式:C;F。
⑷G 中不同化学环境的氢原子有种。
⑸完成下列反应的化学方程式:
A→H;
B→D(第①步);
E→G。