已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |
如图所示,将铁棒和石墨棒插入1L 1mol﹒L-1食盐水中。下列说法正确的是
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH- -4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成1 mol NaOH |
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,则下列说法不正确的是 
| A.电源a极为负极 |
| B.KI—淀粉溶液会变蓝 |
| C.可以将惰性电极Ⅰ换为铜棒 |
| D.惰性电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+ |
下图为Mg—NaClO燃料电池结构示意图。下列说法正确的是( )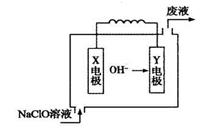
| A.镁作Y电极 |
| B.电池工作时Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为:ClO-+2H2O-4e-= ClO3-+4H+ |
下列各溶液中,微粒的物质的量浓度关系正确的是()
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是()
| A.图中五点Kw间的关系:B>C>A=D=E |
| B.C点一定是纯水 |
| C.D点可能是醋酸溶液,E点可能是醋酸钠溶液 |
| D.100℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |