某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________________和______________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为____________________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
| 醋酸溶液浓度(mol·L-1) |
0.001 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案
________________________________________
实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
(1)溶解时
(2)过滤时
(3)蒸发时
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴
⑵。
如右图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.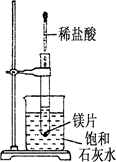
试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式:
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”或“等于”)镁片和盐酸的总能量.
实验室需要450ml 0.12mol/L 的NaOH溶液,有如下操作:
的NaOH溶液,有如下操作:
①把称好的NaOH放入小烧杯中,加适量蒸馏水溶解。
②根据计算用托盘天平称取NaOH 克。
克。
③把①所得溶液小心转 入一定容积的容量瓶中。
入一定容积的容量瓶中。
④继续向容量瓶中加蒸馏水至液面距刻度线1cm-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
⑤用少量蒸馏水洗涤烧杯和玻璃棒2-3次 ,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑥将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
⑴上述步骤中要称量的NaOH固体为克
⑵操作步骤的正确顺序为(填序号)。
⑶实验室有如下规格的容量瓶:①100mL ②250mL ③500mL ④1000mL,本实验选用
(填序号)。
⑷本实验用到的基本实验仪器除托盘天平, 药匙以外还有:。
药匙以外还有:。
⑸误差 分析:(填“偏高”、“偏低”或“无影响”)
分析:(填“偏高”、“偏低”或“无影响”)
①称量NaOH固体时,物码倒置(1克以下用游码)
②没有进行操作步骤⑤
③容量瓶中原来有少量水
④某同学定容时俯视容量瓶刻度线
⑤定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切。