为了测定中和反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
| A.①②③⑥ | B.①③④⑥ |
| C.③④⑤⑥ | D.全部 |
下列有机反应在酸、碱性条件下都能进行的是
| A.银镜反应 | B.乙醇脱水 |
| C.油脂水解 | D.溴乙烷水解 |
以下工业上或实验室里催化剂的使用不符合事实的是
| A.氨氧化-三氧化二铬 | B.乙醇氧化-铜 |
| C.合成氨-铁触媒 | D.二氧化硫氧化-铂铑合金 |
实验室常用全是磨砂接口的曲颈甑制取HNO3(如图),反应的化学方程式为:NaNO3+H2SO4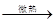 NaHSO4+HNO3↑用曲颈甑是因为HNO3
NaHSO4+HNO3↑用曲颈甑是因为HNO3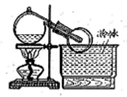
| A.会腐蚀橡胶 | B.易挥发 |
| C.易分解 | D.是强电解质 |
以下变化后物质的总能量升高的是
| A.钢铁生锈 | B.气态SO3变成固态三聚物 |
| C.水电解 | D.1,3-环己二烯生成苯 |
以下物质保存方法错误的是
| A.钠-煤油中 | B.氢氟酸-塑料瓶中 |
| C.白磷-水中 | D.无水氯化钙-细口瓶中 |