某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。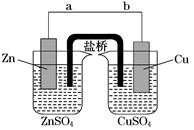
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
聚酯纤维是化学纤维中的第一大品种,聚已二酸乙二酯就是一种重要的聚酯纤维,可用于制造性能各异的聚氨酯泡沫塑料,弹性体、涂粘和粘接剂等。目前经典的合成路线是使用来源丰富的有机原料A和常见单质D,经过一系列反应,同时合成聚已二酸乙二酯与另一种生产生活中常用高聚物E,合成路线如下图所示。根据图示回答下列问题:
(1)写出E、G的结构简式:E,G;
(2)反应②的化学方程式(包括反应条件)是。
反应④的反应条件是;
(3)写出①、⑤的反应类型:①,⑤。
(4)满足下列构成条件的G的同分异构体有种。
|
A.分子中有2个-COOH; B.分子中有1个—CH—,2个CH2—
(5)某同学查阅资料后提出,也可以用A与某种无机分子反应,直接得到F,该反应的原子利用率为100%,请写出该反应的化学方程式(不必注明反应条件)。
溴及其化合物在人类生产生活中有广泛应用。大量的溴用于制造感光材料和染料,化学试剂和医学药物等,家用药箱中的必备药品红汞就是溴汞化合物。
茫茫大海是溴的“故乡”,早在19世纪初,法国化学家就发明了提取溴的空气吹出法工艺,这个方法也是目前工业规模海水提滚的成熟方法。其工艺流程如下:
|
今年初爆发的农夫山泉与统一饮料的“砒霜门事件”引起了人们对砷的生理作用的关注。砒霜是砷的氧化物,化学式为As2O3,砷在周期表中与氢、磷属于同族元素。该族元素与生物体的生命活动密切相关。被称为“生命之族”。如氮、磷是生物体中不可缺少的元素,在生命体中占有板其重要的地位。而砷和锑的某些化合物则有毒,所以中世纪的西方炼金术上曾分别用毒蛇和狼来作为砷和锑的符号。
|
|
(1)砷的基态原子的价电子排布式是 。右上图是元素周期表的局部示意图,请将氮、磷、砷的元素的符号填入表中相应的位置。
(2)下列关于该元素的说法中正确的是 。(每空2分,共10分)
四川汶川盛产品质优良的甜樱桃。甜樱桃中含有一种羟基酸(用A表示)。A的碳链结构无支链,化学式为C4H6O5;1.34g A与足量的NaHCO3溶液反应,生成标准状况下的气体0.448 L。A在一定条件下可发生如下转化:
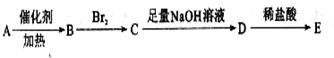
 其中:B、C、D、E分别代表一种直链有机物,它们的碳原子数相等。E的化学式为C4H6O6(转化过程中生成的其它产物略去)。
其中:B、C、D、E分别代表一种直链有机物,它们的碳原子数相等。E的化学式为C4H6O6(转化过程中生成的其它产物略去)。 已知:
已知:
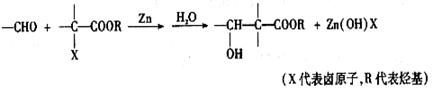

 A的合成方法如下:
A的合成方法如下:
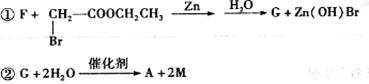
 其中,F、G、M分别代表一种有机物。
其中,F、G、M分别代表一种有机物。 请回答下列问题:
请回答下列问题: (1)A的结构简式是_____________________。
(1)A的结构简式是_____________________。 (2)C生成D的化学方程式是 。
(2)C生成D的化学方程式是 。 (3)A与乙醇混合发生分子间脱水,可能生成的有机物共有 种。
(3)A与乙醇混合发生分子间脱水,可能生成的有机物共有 种。 (4)F的结构简式是 。
(4)F的结构简式是 。 (5)写出G与H2O反应生成A和M的化学方程式: 。
(5)写出G与H2O反应生成A和M的化学方程式: 。
(每空2分,共14分)
中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散,苯氯乙酮是一种具有荷花香味且具有强催泪作用的化学毒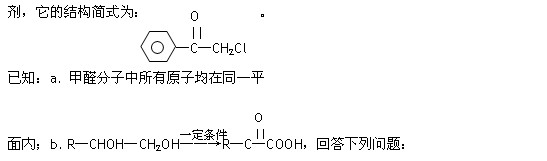
(1)苯氯乙酮分子中,在同一平面内的碳原子最多有个。
(2)苯氯乙酮不可能发生的化学反应是。
| A.加成反应 | B.取代反应 | C.消去反应 | D.水解反应 E.银镜反应 |
(3)分子中有苯环但不含甲基,且能发生银镜反应的苯氯乙酮的同分异构体有种。
(4)苯氯乙酮的一种同分异构体有下列转化关系: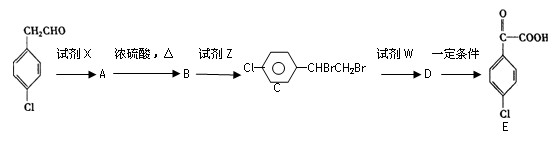
请写出:
①B的结构简式:,试剂X为。
②下列转化的化学方程式A→B;
A+E→F;