(2分)已知Na与H2O发生反应:2Na +2H2O ="2NaOH" +H2↑,则4.6gNa溶于_______ g H2O中才能使溶液中Na+与H2O个数之比为1:10。
媒体报道称“酒鬼”酒塑化剂超标2.6倍,塑化剂并非食品或食品添加剂,且对人体有害。一种塑化剂DIBP仅含C、H、O三种元素,相对分子质量小于280,氧的百分含量为23.02%, DIBP分子中苯环上二位取代,且分子中含2个酯基。
(1)DIBP的分子式为。
(2)塑化剂DEHP是DIBP的同系物,存在如图所示的转化关系。
①A是苯环的邻二位取代,则A的结构简式是。
A与乙二醇发生缩聚反应的化学方程式为。
②D分子所含官能团是。
③B分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是。
(3)F是A的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与NaHCO3溶液反应。
写出F与NaHCO3溶液反应的化学方程式。
(4)有机物M与DIBP也互为同系物,分子式为C10H10O4, M核磁共振氢谱出现三组峰,则有机物M的结构可能有种。
(1)主族元素A的简单阳离子不与任何原子具有相同的核外电子排布。元素B与氮元素同周期,B的原子序数大于氮,而第一电离能比氮的小。A与B形成两种化合物A2B2和A2B,其中B的杂化方式分别为、。A2B、NH3、SiH4的键角由大到小依次为(填化学式)。A2B由液态形成晶体时密度减小,主要原因是。
(2)新型无机材料在许多领域被广泛应用。陶瓷发动机的材料选用氮化硅,它硬度高、化学稳定性高,是很好的高温陶瓷材料。除氢氟酸外,氮化硅不与其他无机酸反应,抗腐蚀能力强。氮化硅的晶体类型是,氮化硅与氢氟酸反应的化学方程式为。
(3)MgCO3和CaCO3都为离子晶体,热分解的温度分别为402℃和900℃,请根据结构与性质的关系说明它们热分解温度不同的原因。
(4)砷化镓广泛用于雷达、电子计算机、人造卫星,宇宙飞船等尖端技术中。镓的基态原子价电子排布式为,砷化镓的晶胞结构与金刚石相似,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为g(用NA表示阿伏加德罗常数),该晶胞中Ga与As的最短距离为cm。
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 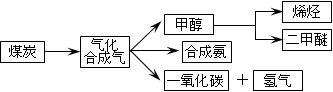
I.已知该产业链中某反应的平衡表常数达式为:K=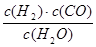 ,它所对应反应的化学方程式为。
,它所对应反应的化学方程式为。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为。
830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a=mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c(mol/L) |
0.8 |
1.24 |
1.24 |
①此时刻v正v逆(填“大于”“小于”或“等于”
②平衡时二甲醚的物质的量浓度是。
以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL2mol/L CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为
(10 分)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为。
(2)加入H2O2氧化时,发生反应的化学方程式为。
(3)滤渣2 的成分是(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C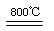 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。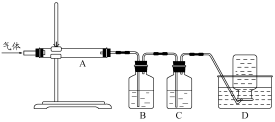
①D中收集的气体可以是(填化学式)。
②B中盛放的溶液可以是(填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:。
在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。根据上述信息,回答下列问题: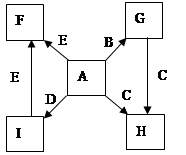

(1)I的电子式为 ,G的俗名是。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为。
(3)根据E和A反应的能量变化图像写出热化学方程式:。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离
子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数。