1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
CH2=CH2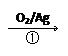

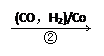 HOCH2CH2CHO
HOCH2CH2CHO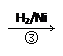 HOCH2CH2CH2OH
HOCH2CH2CH2OH
⑴通过反应①用乙烯和空气混合气体制备 ,测得反应前和某一时刻气体的体积分数如下表。
,测得反应前和某一时刻气体的体积分数如下表。
| |
C2H4 |
O2 |
N2 |
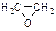 |
| 反应前体积分数 |
25.0% |
15.0% |
60.0% |
0 |
| 某一时刻体积分数 |
5.56% |
5.54% |
66.7% |
22.2% |
计算此时乙烯的转化率。
⑵某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%。
计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
一切化学反应除了有质量的 变化外,还伴随着的变化,它们分别遵循定律和定律。能量变化通常主要表现为的变化,即或者。
变化外,还伴随着的变化,它们分别遵循定律和定律。能量变化通常主要表现为的变化,即或者。
在NaCl、NaOH、N2、H2S中,只含有离子键的是,只含有 极性键的是,只含有非极性键的是,既含有离子键又含有极性键的是。
极性键的是,只含有非极性键的是,既含有离子键又含有极性键的是。
下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
(1)写出下列元素的元素符号:①②
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是,最不活泼的元素是。
,最活泼的非金属元素是,最不活泼的元素是。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是。
(4)在③与④的单质中,化学性质较活泼的是,判断依据是;在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是。
,判断依据是。
(5)⑾与⑿原子序数之差
某微粒的结构示意图为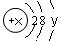 试回答:
试回答:
(1)当x-y=10时,该粒子为(填“原子”或“阳离子”“阴离子”)
(2)当y=8时,该粒子可能是
(写名称):、、、、。
(3)写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式。
(1)写出表示含有8个质子、10个中子、10个电子的离子的符号。
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行族。
(4)试将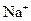 、
、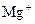 、
、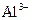 、
、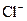 、
、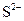 等五种离子按半径由大到小的顺序排列(用离子符号表示)____________________。
等五种离子按半径由大到小的顺序排列(用离子符号表示)____________________。