下列溶液中,微粒浓度关系正确的是( )
| A.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度可能是c(Cl-)> c(NH4+)>c(OH-)>c(H+) |
| B.常温下pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.1 mol·L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.常温下pH=3的一元酸和pH=11的一元碱等体积混合后的溶液中一定是c(OH-)=c(H+) |
将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
| A.11.5倍 | B.5.75倍 | C.23倍 | D.30.67倍 |
可逆反应mA(g)+nB(g) pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示
pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示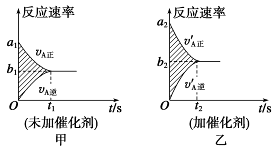
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影部分面积更大。以上所列正确的为
| A.②④⑥⑧ | B.②④⑤⑦ | C.②③⑤⑦ | D.②③⑥⑧ |
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)  H2(g)+I2(g)。若c(HI)由0.1 mol/L 降到0.07 mol/L时,需要15 s,那么c(HI)由0.07 mol/L 降到0.05 mol/L时,所需反应的时间为
H2(g)+I2(g)。若c(HI)由0.1 mol/L 降到0.07 mol/L时,需要15 s,那么c(HI)由0.07 mol/L 降到0.05 mol/L时,所需反应的时间为
| A.等于5 s | B.等于10 s | C.大于10 s | D.小于10 s |
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
| A.n>p |
| B.x点表示的正反应速率小于逆反应速率 |
| C.x点比y点时的反应速率慢 |
| D.若升高温度,该反应的平衡常数增大 |
高温下,某反应达平衡,平衡常数K= ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.升高温度,逆反应速率减小 |
| C.恒温恒容下,增大压强,H2浓度一定减小 |
D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |